
A、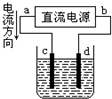 d极发生氧化反应、c极发生还原反应 |
B、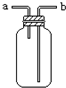 从a口通入气体,可用于收集H2、NH3、NO等气体 |
C、 X若为CCl4,上层为稀硫酸,可用于吸收氨气,并防止倒吸 |
D、 可用于干燥、收集氯化氢,并吸收多余的氯化氢 |


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
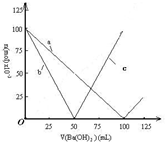 烧杯中盛有100mL 0.1mol/L的NaHSO4溶液,向其中逐滴滴加0.1mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图.下列说法正确的是( )
烧杯中盛有100mL 0.1mol/L的NaHSO4溶液,向其中逐滴滴加0.1mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图.下列说法正确的是( )| A、曲线a表示Ba2+的物质的量的变化 |
| B、曲线c表示OH-的物质的量的变化 |
| C、加入Ba(OH)2溶液50mL反应的离子方程式为Ba2++OH-+H++SO42-→BaSO4↓+H2O |
| D、加入Ba(OH)2溶液大于50mL后,反应的离子方程式为 OH-+H+→H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
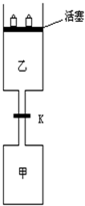 连通装置是化学研究的重要装置起始时,甲、乙体积均为1L,向甲、乙中均充入1.5mol A、3.5mol B,关闭阀门K.在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3A(g)+2B(g)?C(g)+2D(g)+200KJ.5分钟时甲达平衡,此时乙容器的体积为0.86L.请回答以下问题:
连通装置是化学研究的重要装置起始时,甲、乙体积均为1L,向甲、乙中均充入1.5mol A、3.5mol B,关闭阀门K.在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3A(g)+2B(g)?C(g)+2D(g)+200KJ.5分钟时甲达平衡,此时乙容器的体积为0.86L.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
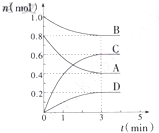 在T℃时,在容积为0.5L的密闭容器中发生如下反应:mA(g)+nB(g)?pC(g)+qD(s),△H<0(m、n、p、q为最简整数比).A、B、C、D物质的量的变化如图所示:
在T℃时,在容积为0.5L的密闭容器中发生如下反应:mA(g)+nB(g)?pC(g)+qD(s),△H<0(m、n、p、q为最简整数比).A、B、C、D物质的量的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生铁比纯铁更易生锈 |
| B、黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| C、银质奖章久置后易表面变暗 |
| D、海轮上一般会在吃水线下绑定一定量的锌块 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com