
| 44.8L |
| 22.4L/mol |
| (1-0)×2 |
| (7-4) |
| 44.8L |
| 22.4L/mol |


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
A、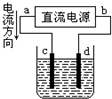 d极发生氧化反应、c极发生还原反应 |
B、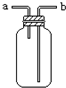 从a口通入气体,可用于收集H2、NH3、NO等气体 |
C、 X若为CCl4,上层为稀硫酸,可用于吸收氨气,并防止倒吸 |
D、 可用于干燥、收集氯化氢,并吸收多余的氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:
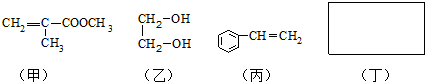
| 稀硫酸 |
| △ |
| 一定条件 |
| 浓硫酸 |
| 170℃ |
| 试剂X |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
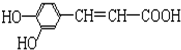
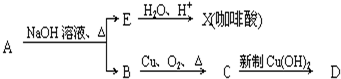
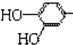 结构;②能发生水解反应;R的结构简式为
结构;②能发生水解反应;R的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业生产玻璃、水泥、陶瓷,均需要用石灰石为原料 |
| B、硅单质可用于制造光导纤维 |
| C、2011年5月份起,面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,过氧化苯甲酰属于有机物 |
| D、固体煤经处理变为气体燃料后,可以减少SO2和烟尘的排放,且燃烧效率提高,有利于“节能减排” |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①和② | B、②和③ |
| C、①和③ | D、只有③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有② | B、①②③⑤ |
| C、①②③④ | D、①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入过量的Ba(OH)2溶液时:2Al3++3SO42-+3Ba2++6OH-→2Al(OH)3↓+3BaSO4↓ |
| B、溶液恰好呈中性时:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
| C、SO42-离子恰好完全沉淀时:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| D、明矾与Ba(OH)2按物质的量比1:1反应时:Al3++SO42-+Ba2++3OH-→Al(OH)3↓+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
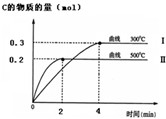 (1)已知在25℃时:①2CO (s)+O2(g)═2CO2(g)△H1=-566KJ/mol
(1)已知在25℃时:①2CO (s)+O2(g)═2CO2(g)△H1=-566KJ/mol查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com