
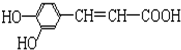
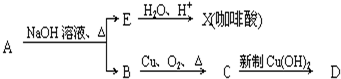
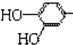
 结构;②能发生水解反应;R的结构简式为
结构;②能发生水解反应;R的结构简式为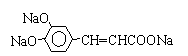 ,由碳原子守恒可知,B、C、D中均含2个碳原子,B催化氧化生成C,C与氢氧化铜反应生成D,则B为乙醇,C为乙醛,D为乙酸;
,由碳原子守恒可知,B、C、D中均含2个碳原子,B催化氧化生成C,C与氢氧化铜反应生成D,则B为乙醇,C为乙醛,D为乙酸; 结构;②能发生水解反应,则含-COOC-,以此来解答.
结构;②能发生水解反应,则含-COOC-,以此来解答. ,由碳原子守恒可知,B、C、D中均含2个碳原子,B催化氧化生成C,C与氢氧化铜反应生成D,则B为乙醇,C为乙醛,D为乙酸,
,由碳原子守恒可知,B、C、D中均含2个碳原子,B催化氧化生成C,C与氢氧化铜反应生成D,则B为乙醇,C为乙醛,D为乙酸, ,
, ;
;| Cu |
| △ |
| Cu |
| △ |
 结构;②能发生水解反应,则含-COOC-,则R的结构简式为
结构;②能发生水解反应,则含-COOC-,则R的结构简式为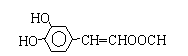 或
或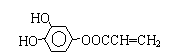 ,
, 或
或 .
.


科目:高中化学 来源: 题型:
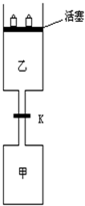 连通装置是化学研究的重要装置起始时,甲、乙体积均为1L,向甲、乙中均充入1.5mol A、3.5mol B,关闭阀门K.在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3A(g)+2B(g)?C(g)+2D(g)+200KJ.5分钟时甲达平衡,此时乙容器的体积为0.86L.请回答以下问题:
连通装置是化学研究的重要装置起始时,甲、乙体积均为1L,向甲、乙中均充入1.5mol A、3.5mol B,关闭阀门K.在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3A(g)+2B(g)?C(g)+2D(g)+200KJ.5分钟时甲达平衡,此时乙容器的体积为0.86L.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生铁比纯铁更易生锈 |
| B、黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| C、银质奖章久置后易表面变暗 |
| D、海轮上一般会在吃水线下绑定一定量的锌块 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能消毒杀菌又能净水 |
| B、高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
| C、低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放 |
| D、“光化学烟雾”、“臭氧空洞”、“硝酸酸雨”的形成都与氮氧化合物有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:丁>丙>甲 |
| B、单质的还原性:丁>丙>甲 |
| C、甲、乙、丙的氧化物为共价化合物 |
| D、乙、丙、丁的最高价氧化物对应的水化物相互反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com