
| 1 |
| 2 |
| A、920 kJ |
| B、557 kJ |
| C、436 kJ |
| D、188 kJ |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
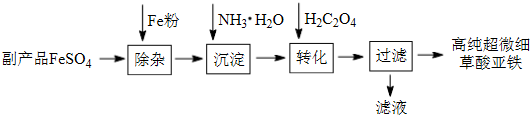
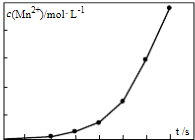
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、温度不变,增大容器的体积,液体的颜色变浅 |
| B、温度不变,减少容器的体积,S2Cl2的转化率降低 |
| C、压强不变,升高温度,液体的颜色变浅 |
| D、体积不变,降低温度,氯气的转化率升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若pH<7时,则一定是c1V1=c2V2 |
| B、该混合液中,c(NH4+)+c(H+)═c(Cl-)+c(OH-) |
| C、当pH=7时,若V1=V2,则一定是c2> c1 |
| D、若V1=V2,c1=c2,则c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子式为C4H8有机物最多存在4个C-C单键 |
B、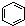 和 和 均是芳香烃, 均是芳香烃, 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 |
C、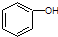 和 和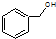 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 |
| D、乙酸分子中含有碳氧双键,所以它能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
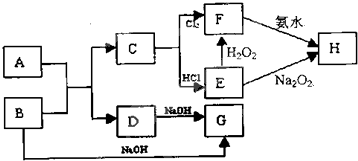
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com