
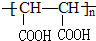 .
. 分析 (1)有机物A由C、H、O三种元素组成,其相对分子质量为90,氧的质量分数为71.1%,则分子中N(O)=$\frac{90×71.1%}{16}$=4,剩余C、H原子总相对分子质量为90-64=26,则含有2个C原子、2个H原子,故A的分子式为C2H2O4;
(2)A能与NaHCO3溶液反应放出CO2,则A为HOOC-COOH;
(3)链状化合物B的分子式为C4H4O4,1molB在酸性高锰酸钾溶液中只生成2molA,则B为HOOC-CH=CH-COOH.
解答 解:(1)有机物A由C、H、O三种元素组成,其相对分子质量为90,氧的质量分数为71.1%,则分子中N(O)=$\frac{90×71.1%}{16}$=4,剩余C、H原子总相对分子质量为90-64=26,则含有2个C原子、2个H原子,故A的分子式为C2H2O4,故答案为:C2H2O4;
(2)A能与NaHCO3溶液反应放出CO2,则A为HOOC-COOH,A与足量的乙醇反应的化学方程式:HOOC-COOH+2CH3CH2OH$→_{△}^{浓硫酸}$CH3CH2OOOC-COOCH2CH3+2H2O,属于取代反应,
故答案为:HOOC-COOH+2CH3CH2OH$→_{△}^{浓硫酸}$CH3CH2OOOC-COOCH2CH3+2H2O;取代反应;
(3)链状化合物B的分子式为C4H4O4,1molB在酸性高锰酸钾溶液中只生成2molA,则B为HOOC-CH=CH-COOH,B与溴的四氯化碳溶液反应的化学方程式为:HOOC-CH=CH-COOH+Br2→HOOC-CHBrCHBr-COOH,在一定条件下,由B加聚得到的高分子化合物的结构简式为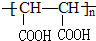 ,
,
故答案为:HOOC-CH=CH-COOH+Br2→HOOC-CHBrCHBr-COOH;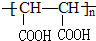 .
.
点评 本题考查有机物分子式与结构式确定,关键是计算确定分子式,熟练掌握官能团的性质与转化.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 布洛芬具有解热镇痛作用,常规剂量使用时,不良反应发生率低,是国内外包括世界卫生组织公认的用于小儿发热的经典解热镇痛药.布洛芬的结构简式如图:
布洛芬具有解热镇痛作用,常规剂量使用时,不良反应发生率低,是国内外包括世界卫生组织公认的用于小儿发热的经典解热镇痛药.布洛芬的结构简式如图: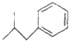 $→_{AlCl_{3}}^{CH_{3}COCl}$A$\stackrel{H_{2}}{→}$
$→_{AlCl_{3}}^{CH_{3}COCl}$A$\stackrel{H_{2}}{→}$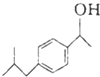 $\stackrel{CO}{→}$布洛芬
$\stackrel{CO}{→}$布洛芬 +
+ $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$ +HCl,请写出A的结构简式
+HCl,请写出A的结构简式

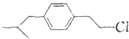 为原料合成布洛芬(用合成路线流程图表示;无机原料任选,并注明反应条件).
为原料合成布洛芬(用合成路线流程图表示;无机原料任选,并注明反应条件). .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取15.80g NaCl固体 | |
| B. | 用10mL量筒量取6.25 mL稀硝酸 | |
| C. | 用精密pH试纸测得某溶液的pH为4.2 | |
| D. | 做中和滴定实验时,用50mL规格的酸式滴定管去取17.90mL的烧碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH4、NH3、H20和HF均为含10e-的分子.
CH4、NH3、H20和HF均为含10e-的分子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | H2S溶液无法制取H2SO4 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸中,铁丝在浓硫酸中先反应完 |
| C | 离子反应总是向着某种离子浓度减小的方向进行 | 反应2Na+2CH3COOH═2Na++2CH3COO-+H2↑不能进行 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | MgCO3沉淀在水中煮沸,最终转化为Mg(OH)2沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先加入BaCl2溶液,再加入足量的HCl溶液,产生了白色沉淀.溶液中一定含有大量的SO42- | |
| B. | 加入足量的CaCl2溶液,产生了白色沉淀.溶液中一定含有大量的CO32- | |
| C. | 加入足量浓 NaOH溶液,产生了带有强烈刺激性气味的气体.溶液中一定含有大量的NH4+ | |
| D. | 先加适量的盐酸将溶液酸化,再加AgNO3溶液,产生了白色沉淀.溶液中一定含有大量的Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com