
| 5.6L |
| 22.4L/mol |
| 1mol |
| 0.5mol |
| 1mol |
| 3 |
| 1mol |
| 2 |
| 1mol |
| 2 |


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
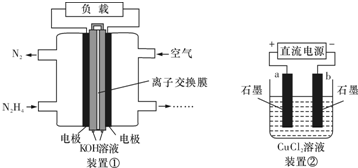
| A、该燃料电池负极发生的电极反应为:N2H4+4OH--4e-═N2+4H2O |
| B、用该燃料电池作为装置②的直流电源,产生1 mol Cl2至少需要通入0.5 mol N2H4 |
| C、该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
| D、该燃料电池中,电子从右侧电极经过外电路流向左侧电极,溶液中OH-则迁移到左侧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、催化剂 | B、还原剂 |
| C、氧化剂 | D、稳定剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com