
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是
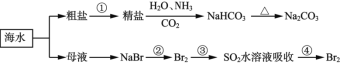
A.制取NaHCO3的反应是利用其溶解度小于NaCl
B.侯氏制碱应先通NH3再通CO2
C.在第②、③、④步骤中,溴元素均被氧化
D.③④的目的是进行溴的富集
【答案】C
【解析】
A. 往精盐溶液中通入氨气和二氧化碳,得到碳酸氢钠沉淀,说明碳酸氢钠的溶解度小于氯化钠,故A正确;
B. 由于CO2在水中的溶解度较小,而NH3的溶解度较大,所以要在食盐水先通NH3然后再通CO2,否则CO2通入后会从水中逸出,等再通NH3时溶液中CO2的量就很少了,这样得到的产品也很少,故B正确;
C. 在第②、④步骤中溴离子转化为溴单质,溴的化合价升高失电子,被氧化,步骤③中溴单质和二氧化硫反应生成硫酸和溴化氢,溴元素化合价降低得电子被还原,故C错误;
D. 浓缩后增大溴离子的浓度,与氯气发生2Br-+C12=Br2+2CI-,用空气和水蒸气将溴吹出,并用SO2氧化吸收,从而达到富集溴,③中发生Br2+ 2H2O+SO2=2HBr+H2SO4,④中发生Cl2+ 2HBr=Br2+ 2HCI,则③④的目的是进行溴的富集,故D正确;
答案选C。


科目:高中化学 来源: 题型:
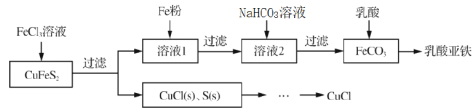
【题目】以黄铜矿(CuFeS2)、FeCl3和乳酸[CH3CH(OH)COOH]为原料可制备有机合成催化剂CuCl和补铁剂乳酸亚铁{[CH3CH(OH)COO]2Fe}。其主要实验流程如下:
已知:①乳酸亚铁是绿白色晶体,溶于水,几乎不溶于乙醇。
②CuCl为白色晶体,难溶于水和乙醇,在空气中易氧化;可与NaCl溶液反应,生成易溶于水的NaCuCl2。
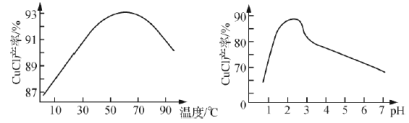
③NaCuCl2可水解生成CuCl,温度、pH对CuCl产率的影响如图所示。
(1)FeCl3溶液与黄铜矿发生反应的离子方程式为_______________。
(2)向溶液1中加入过量铁粉的目的是______________。
(3)下列有关实验说法不正确的是______________。(填编号)
A.减压过滤使用的滤纸,为确保把所有的孔都覆盖住,应使滤纸大于布氏漏斗内径
B.为得到干燥的乳酸亚铁晶体,采用高温烘干的方式干燥
C.洗涤CuCl沉淀时,关小抽气泵,向布氏漏斗中加乙醇没过沉淀,并用玻璃棒搅拌
D.为得到较大的乳酸亚铁晶体颗粒,可投入几粒晶种并减缓溶液冷却速度
(4)若向NaHCO3溶液中加入FeSO4溶液,得到的FeCO3不纯,其原因是___________。
(5)用高锰酸钾标准液测定乳酸亚铁产品纯度,配制该标准溶液时,下列仪器中不必要用到的有_________。(用编号表示)。
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
下列操作会引起结果偏高的是____________(用编号表示)。
A.滴定前,滴定管和锥形瓶分别用标准液与待测液润洗
B.配制高锰酸钾溶液定容时,仰视刻度线
C.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡
D.加待测液前锥形瓶内有少量水
E.滴定前俯视读数,滴定后仰视读数
(6)由CuCl(s)、S(s)混合物提纯CuCl的实验方案为:将一定量的混合物溶于饱和NaCl溶液中,_______。(需要用到下列所有操作,给出正确的顺序)
①滤液加热至60℃左右 ②趁热过滤 ③过滤 ④用乙醇洗净所得固体
⑤滴加加0.1mol·L-1H2SO4至pH为2.0~2.5 ⑥置于真空干燥箱中干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列叙述错误的是( )
A. 1.8gH2O中含有的质子数为NA
B. 22.4L氯气与足量镁粉充分反应,转移的电子数为2NA
C. 46gNO2和N2O4混合气体中含有原子总数为3NA
D. 23gNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下物质相互转化
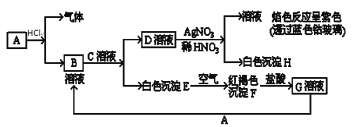
试回答:
(1)写出B的化学式________________;D的名称________________。
(2)写出由E转变成F的化学方程式________________。
(3)写出用KOH鉴别G溶液的离子方程式________________;向G溶液加入A的有关离子方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V 1 mL 0.1mol·L-1的Fe2(SO4)3溶液与2mL 0.1mol·L-1KI溶液混合,待充分反应后,下列方法可证明该反应具有一定限度的是( )
A.若V1<1,加入淀粉B.若V1≤1,加入KSCN溶液
C.若V1≥1,加入AgNO3溶液D.加入Ba(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,向某恒容密闭容器中加入1.6 mol ·L-1的Q后会发生如下反应:2Q(g) ![]() M(g) 。其中M的物质的量浓度随时间的变化如图所示。
M(g) 。其中M的物质的量浓度随时间的变化如图所示。
下列说法错误的是
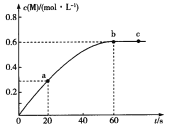
A.从反应开始到刚达到平衡时间段内,v(Q)=0.02 mol·L-1·s-1
B.a、b两时刻生成Q的速率:v(a)<v(b)
C.用Q浓度变化值表示的ab、bc两个时段内的反应速率:v(ab)>v(bc)=0
D.其他条件相同,起始时将0. 2 mol·L-1氦气与Q混合,则反应达到平衡所需时间少于60 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,满足表中图示物质在通常条件下能一步转化的全部组合是
序号 | X | Y | Z | W |
|
Al | NaAlO2 | Al(OH)3 | Al2O3 | ||
② | Na | NaOH | Na2CO3 | NaCl | |
③ | C | CO | CO2 | H2CO3 | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A. ①② B. ①③④ C. ②③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)只用一种试剂或操作,除去下列物质中的杂质(括号内为杂质),先写出除杂时所选试剂或者操作,再写出发生的有关化学方程式。
①Fe2O3(Al2O3):___ ___
②FeCl2溶液(FeCl3):___ ___
③Na2CO3(NaHCO3):___ ___
(2)写出以下反应的化学方程式或离子方程式。
呼吸面具中CO2与过氧化钠反应化学方程式:___;
烧碱溶液与铝片的反应离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
I.氯系消毒剂在生活中有广泛应用。
(1)NaClO2是饮用水的消毒剂,常用FeSO47H2O清除残留的亚氯酸钠。
①Fe2+的电子排布式为[Ar]________________________________。
②与SO42-互为等电子体的分子有____________________(写一种)。
③ClO2-中氯原子的孤电子对数为___________。
④常用K3[Fe(CN)6]检验水中的F2+。K3[Fe(CN)6]的配体是________________。
(2)ClO2是新一代饮用水消毒剂。沸点:ClO2________________(填“>”“<”或“=”)Cl2O,理由是________________________________________________。
Ⅱ.Fe、Cu为过渡金属元素,它们在工业生产中都有重要的应用。
(2)将乙醇蒸气通过赤热的氧化铜粉末,会发生反应:![]()
①有同学书写基态碳原子的核外电子排布图为![]() ,这样的书写不正确,违背了________。
,这样的书写不正确,违背了________。
②乙醛和乙醇的相对分子质量相差2,但是乙醇的沸点远高于乙醛,其主要原因是_______。
(2)Fe、Fe2+都能被硝酸氧化。HNO3中氮原子轨道的杂化类型为_______________________。
(3)NO能被FeSO4溶液吸收生成配合物![]() ,该配合物中心离子的配位数为__________________________。
,该配合物中心离子的配位数为__________________________。
(4)研究发现,阳离子的颜色与未成对电子数有关。例如,Cu2+、Fe2+、Fe3+等。Cu+呈无色,其原因是_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com