
| A. | HCl | B. | CO2 | C. | MgCl2 | D. | KOH |
分析 泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,据此分析解答.
解答 解:A.HCl分子中H-Cl原子之间只存在共价键,为共价化合物,故A错误;
B.二氧化碳分子中C-O原子之间只存在共价键,为共价化合物,故B错误;
C.氯化镁中镁离子和氯离子之间只存在离子键,为离子化合物,故C正确;
D.KOH中钾离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,为离子化合物,故D错误;
故选C.
点评 本题考查离子化合物和共价化合物判断,为高频考点,侧重考查学生分析判断能力,明确物质构成微粒及微粒之间作用力是解本题关键,易错选项是C,注意C中两个氯离子之间不存在化学键,题目难度不大.


科目:高中化学 来源: 题型:实验题
| 滴定次数 | 待测液体积(mL) | 标准NaOH溶液体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 10.80 | 30.70 |
| 第二次 | 25.00 | 14.20 | 34.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
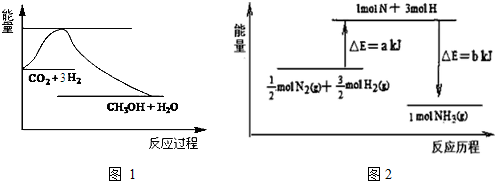
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
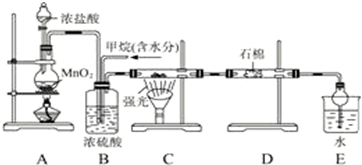
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
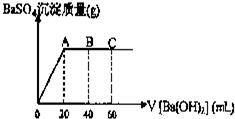 已知在某温度T℃时,某稀硫酸和盐酸混合液中,c(H+)=10-amol•L-1,c(OH-)=10-bmol•L-1,已知a+b=12.向20mL该混合酸溶液中逐滴加入pH=11Ba(OH)2溶液,生成BaSO4的质量与加入的Ba(OH)2溶液体积关系如图所示,当加入60mL Ba(OH)2溶液时,C点溶液的pH=6(体积变化忽略不计),试计算:
已知在某温度T℃时,某稀硫酸和盐酸混合液中,c(H+)=10-amol•L-1,c(OH-)=10-bmol•L-1,已知a+b=12.向20mL该混合酸溶液中逐滴加入pH=11Ba(OH)2溶液,生成BaSO4的质量与加入的Ba(OH)2溶液体积关系如图所示,当加入60mL Ba(OH)2溶液时,C点溶液的pH=6(体积变化忽略不计),试计算:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
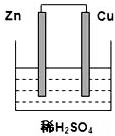 根据如图所示的装置,完成下列各空.
根据如图所示的装置,完成下列各空.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com