

| ||
| ||


科目:高中化学 来源: 题型:
| 浓H2SO4 |
| 170℃ |

查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学为了探究原电池产生电流的过程,设计了如图所示实验.
某同学为了探究原电池产生电流的过程,设计了如图所示实验.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
4 2 |
56 28 |
132 50 |
208 82 |
16 8 |
17 8 |
18 8 |
16 8 |
17 8 |
18 8 |
298 114 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
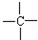 和
和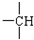 等结合成的.如果某烷分子中同时存在这4种基团,所含碳原子数最小,这种烷烃分子应含
等结合成的.如果某烷分子中同时存在这4种基团,所含碳原子数最小,这种烷烃分子应含查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸、Na2CO3溶液、NaCl溶液、AgNO3溶液 |
| B、Cl2、HCl、HBr |
| C、BaCl2溶液、NaOH溶液、AgNO3溶液、NaCl溶液 |
| D、NaCl溶液、NaBr溶液、NaI溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com