
【题目】根据合成氨反应的能量变化示意图,下列有关说法正确的是( )
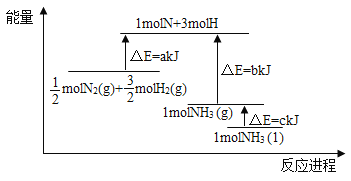
A. 若合成氨反应使用催化剂,反应放出的热量增多
B. 断裂0.5moIN2(g)和1.5molH2(g)中所有的化学键释放akJ热量
C. 2NH3(l)= N2(g)+3H2(g) △H=2(b+c-a) kJ/mol
D. N2(g)+3H2(g)=2NH3(g) △H=-2(a-b)kJ/mol
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】高纯MnCO3在电子工业中有重要的应用,工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如图所示:

已知:还原焙烧主反应为2MnO2+C![]() 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:

根据要求回答下列问题:
(1)在实验室进行步骤A,混合物应放在__________中加热;步骤C中的滤渣为__________。
(2)步骤D中氧化剂与还原剂的物质的量之比为__________。
(3)步骤E中调节pH的范围为____________,其目的是______________________________。
(4)步骤G,温度控制在35℃以下的原因是____________________________________,若Mn2+恰好沉淀完全时测得溶液中CO32-的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=____________。
(5)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否干净的方法是_____________________。
(6)现用滴定法测定产品中锰元素的含量。实验步骤:称取3.300 g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnCO3完全转化为[Mn(PO4)2]3-(其中NO3-完全转化为NO2-);加入稍过量的硫酸铵,发生反应NO2-+NH4+=N2↑+2H2O以除去NO2-;加入稀硫酸酸化,再加入60.00 mL 0.500 mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO43-;用5.00 mL 0.500 mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为_____________________________________。
②试样中锰元素的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为_____。
(2)把Na2CO3和NaHCO3的混合物29.6g加热到质量不再变化时,得残留固体26.5g;则原混合物中Na2CO3的物质的量为:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
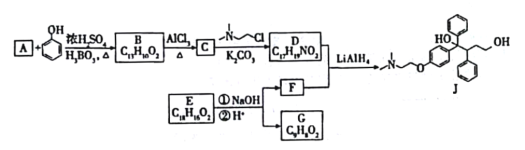
【题目】抗癌药托瑞米芬的前体J的合成路线如下。
已知:
i.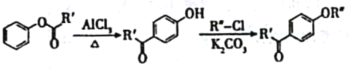
ii.有机物结构可用键线式表示,如(CH3)2NCH2CH3的键线式为![]()
(1)有机物A能与Na2CO3溶液反应产生CO2,其钠盐可用于食品防腐,其名称为_______________.
(2)C中含有的官能团为______________________________(填名称)。
(3)C→D的化学反应方程式为_________________________,反应类型为______________________。
(4)E是一种天然香料,经碱性水解、酸化,得F和G。G经还原可转化为F。G的结构简式为________________________________。
(5)K是G的同分异构体,符合下列条件的K的结构简式是_____________________。(任意写一种)
①包含2个六元环
②K可水解,与NaOH溶液供热时,1molK消耗1molNaOH
(6)推测D和F反应得到J的过程中,反应物LiAIH4的作用是_________________。
(7)由J合成托瑞米芬的古城:
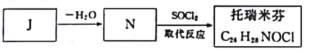
托瑞米芬具有反应结构,其结构简式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固定容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
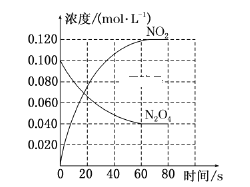
(1)反应的ΔH________(填“大于”或“小于”)0;100 ℃时,体系中各物质浓度随时间变化如上图所示。在0~60 s时段,反应速率v(N2O4)为______________________________。
(2)100 ℃时达到平衡后,改变反应温度为T,c(N2O4)降低,经10 s又达到平衡。
①T________(填“大于”或“小于”)100 ℃,判断理由是_____________________;
②100 ℃时达到平衡后,向容器中再充入0.20 mol NO2气体,新平衡建立后,NO2的体积分数________(填“增大”“不变”或“减小”)。
(3)温度T时反应达平衡后,将反应容器的容积减小一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法不正确的是![]()
A.“酸雨”、“臭氧层受损”、“光化学烟雾”都与氮氧化物有关
B.PM2.5作为空气质量预报的一项重要指标,它是指空气中直径小于或等于2.5m的颗粒物,该值越高,代表空气污染程度越严重
C.静电除尘治理悬浮颗粒污染,其依据是胶体的电泳原理
D.为消除碘缺乏症,卫生部规定食盐中必须加含碘物质,食盐中所加含碘物质是KI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO。实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生。

(1)铜与稀硝酸反应的化学方程式为_________________。
(2)NO是大气污染物之一。目前有一种治理方法是在400℃左右、有催化剂存在的情况下,用氨气把NO还原为氮气和水。该反应的化学方程式为4NH3+6NO![]() 5N2+6H2O,每有5 mol N2生成,氧化产物与还原产物的物质的量之比为__________。
5N2+6H2O,每有5 mol N2生成,氧化产物与还原产物的物质的量之比为__________。
(3)若将上述稀硝酸换成浓硝酸,其生成的气体通入水中,该气体与水反应的化学方程式为______________________________________________。
(4)①写出实验室由NH4Cl和Ca(OH)2加热制取氨气的化学方程式__________。
②进行喷泉实验,若在水中加入酚酞,得到红色喷泉。该实验体现了氨气的两个重要性质分别是________________________、___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g) ΔH=-Q kJ·mol1(Q>0)。在温度为T1时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,经过4 min反应达到平衡,平衡时H2O(g)的物质的量分数为2%,则下列说法不正确的是
COS(g)+H2O(g) ΔH=-Q kJ·mol1(Q>0)。在温度为T1时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,经过4 min反应达到平衡,平衡时H2O(g)的物质的量分数为2%,则下列说法不正确的是
A.CO2的平衡转化率α=2.5%
B.0~4 min内用H2S表示该反应的速率为0.001 mol·L1·min1
C.上述条件下反应达到平衡时放出的热量为0.01Q kJ
D.其他条件不变,若该反应在温度为T2条件下进行,达到平衡所需时间小于4 min,则T1<T2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com