
【题目】高纯MnCO3在电子工业中有重要的应用,工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如图所示:

已知:还原焙烧主反应为2MnO2+C![]() 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:

根据要求回答下列问题:
(1)在实验室进行步骤A,混合物应放在__________中加热;步骤C中的滤渣为__________。
(2)步骤D中氧化剂与还原剂的物质的量之比为__________。
(3)步骤E中调节pH的范围为____________,其目的是______________________________。
(4)步骤G,温度控制在35℃以下的原因是____________________________________,若Mn2+恰好沉淀完全时测得溶液中CO32-的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=____________。
(5)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否干净的方法是_____________________。
(6)现用滴定法测定产品中锰元素的含量。实验步骤:称取3.300 g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnCO3完全转化为[Mn(PO4)2]3-(其中NO3-完全转化为NO2-);加入稍过量的硫酸铵,发生反应NO2-+NH4+=N2↑+2H2O以除去NO2-;加入稀硫酸酸化,再加入60.00 mL 0.500 mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO43-;用5.00 mL 0.500 mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为_____________________________________。
②试样中锰元素的质量分数为____________。
【答案】坩埚 C、 Cu和CaSO4 1∶2 3.7≤pH<8.1 使Fe3+转化为Fe(OH)3而除去,而不影响Mn2+ 减少碳酸氢铵的分解,提高原料利用率 2.2×10-11 取少量最后一次的洗涤液于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净 6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O 25%
【解析】
(1)~(5)原料加木炭焙烧,主要发生2MnO2+C![]() 2MnO+CO2↑,且C与Fe2O3、CuO发生反应,生成Fe、Cu,再用硫酸酸浸过滤得到MnSO4、FeSO4溶液,过滤分离出滤渣为不和稀硫酸反应的Cu、过量的木炭以及碳酸钙转化成的CaSO4,再氧化、调节pH除去Fe3+得到MnSO4溶液,最后与NH4HCO3反应生成MnCO3,分离烘干得到MnCO3,以此来解答。
2MnO+CO2↑,且C与Fe2O3、CuO发生反应,生成Fe、Cu,再用硫酸酸浸过滤得到MnSO4、FeSO4溶液,过滤分离出滤渣为不和稀硫酸反应的Cu、过量的木炭以及碳酸钙转化成的CaSO4,再氧化、调节pH除去Fe3+得到MnSO4溶液,最后与NH4HCO3反应生成MnCO3,分离烘干得到MnCO3,以此来解答。
(6)滴定原理为:利用酸性K2Cr2O7滴定剩余的Fe2+的量,从而确定与[Mn(PO4)2]3-反应的Fe2+的量,继而确定Mn元素的量。
(1)高温焙烧物质应在坩埚中进行;根据分析可知滤渣为C、Cu和CaSO4;
(2)步骤D中MnO2被还原成Mn2+,化合价降低2价,Fe2+被氧化成Fe3+,化合价升高1价,根据得失电子守恒,氧化剂与还原剂的物质的量之比为1:2;
(3)此时溶液中的杂质主要为Fe3+,结合表中数据可知步骤E中调节pH的范围为3.7≤pH<8.3,其目的是使铁离子转化为氢氧化铁而除去,而不影响Mn2+;
(4)铵盐不稳定,受热易分解,所以步骤G中温度需控制在35℃以下,减少碳酸氢铵的分解,提高原料利用率;Mn2+恰好沉淀完全时可认为c(Mn2+)=10-5mol/L,Ksp(MnCO3)= c(Mn2+)·c(CO32-)=10-5×2.2×10-6=2.2×10-11;
(5)生成的MnCO3沉淀可能附着有硫酸盐,所以检验是否含有硫酸根即可确认沉淀是否洗涤干净,具体操作为:取少量最后一次的洗涤液于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净;
(6)①酸性K2Cr2O7具有强氧化性,可以把亚铁离子氧化成铁离子,自身被还原成Cr3+,根据电子守恒、电荷守恒和原子守恒可得离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
②根据方程式6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O可知剩余n(Fe2+)= 0.500 mol·L-1×0.005L×6=0.015mol,则与[Mn(PO4)2]3-反应的n(Fe2+)=0.500 mol·L-1×0.06L-0.015mol=0.015mol,根据方程式[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO43-可知n(Mn)=0.015mol,所以锰元素的质量分数为![]() =25%。
=25%。


科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.NaClO(aq)![]() HClO(aq)
HClO(aq)![]() Cl2(g)
Cl2(g)
B.Fe3O4(s)![]() Fe(s)
Fe(s)![]() Fe(NO3)3(aq)
Fe(NO3)3(aq)
C.Cu(s)![]() Cu2O(s)
Cu2O(s)![]() CuSO4(aq)
CuSO4(aq)
D.S(s)![]() SO2(g)
SO2(g)![]() BaSO3(s)
BaSO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:SO2(g)+ 1/2O2(g) ![]() SO3(g) ΔH=―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
SO3(g) ΔH=―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
A. 196.64kJB. 小于98.32kJ
C. 小于196.64kJD. 大于196.64kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钇钡铜氧、汞钡铜氧、汞钡钙铜氧等都是常见的高温超导体。回答下列问题:
(1)钇(39Y)是一种重要的稀土金属,基态Y原子的价电子排布式为______。下列科学家中,在稀土化学领域做出重要贡献的是_________(填标号)。
a.侯德榜 b.屠呦呦 c.徐光宪
(2)BaCO3可用于制备上述高温超导体,其3种组成元素中,第一电离能最大的是______(填元素符号),CO32-的空间构型为________,其中碳原子的杂化方式为________________。
(3)汞钡铜氧晶体的晶胞如下图A所示,通过掺杂Ca2+获得的具有更高临界温度的超导材料如图B所示。
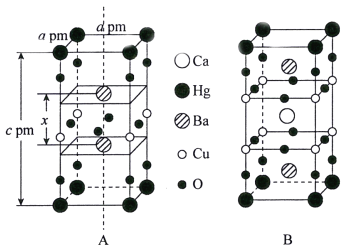
汞钡铜氧晶体的密度为______g·cm-3(设NA为阿伏加德罗常数的值)。图A晶胞中钡离子的分数坐标为(![]() )和_________。掺杂Ca2+所得超导材料的化学式为_________。
)和_________。掺杂Ca2+所得超导材料的化学式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将 0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H = -38.6kJ·mol-1
2NH3(g) △H = -38.6kJ·mol-1
C.HCl 和 NaOH 反应的中和热△H=-57.3 kJ·mol-1 ,则H2SO4和Ba(OH)2反应的中和热 △H = 2×(-57.3)kJ·mol -1
D.在101kPa 时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1) △H =-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.100 mol·L-1 NaOH溶液滴定10 mL 0.100 mol·L-1 H3PO4溶液,曲线如图所示。下列说法正确的是
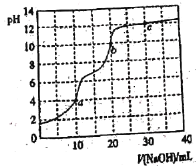
A.滴定终点a可选择酚酞作指示剂
B.c点溶液中c(Na+)>3c(PO43-)+2c(HPO42-)+c(H2PO4-)
C.b点溶液中c(HPO42-)>c(PO43-)>c(H2PO4-)
D.a、b、c三点中水的电离程度最小的是c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙贝特(H)是一种降血脂药物,可明显降低极低密度和低密度脂蛋白水平,并升高高密度脂蛋白,通过改善胆固醇的分布,可减少CH和LDL在血管壁的沉积,还有溶解纤维蛋白和阻止血小板凝聚作用。如图是合成环丙贝特的一种新方法:
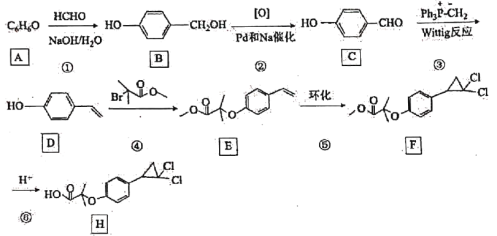
回答下列问题:
(1)B的化学名称为___________。
(2)F中非含氧官能团的名称为___________。
(3)反应①的反应类型为___________,反应④的化学方程式为_______________________。
(4)M为![]() 的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有____种(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为___________。
的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有____种(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为___________。
(5)利用Wittig反应,设计以环己烷为原料(其他试剂任选),制备![]() 的合成路线:____________________________________________。
的合成路线:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包白色固体,可能含有Na2CO3、KNO3、KCl、BaCl2和CuSO4,按下列步骤实验。
①将该固体溶于水得无色溶液。
②向溶液中加入AgNO3溶液,得到白色沉淀,再加足量的稀HNO3,白色沉淀部分溶解并有气泡产生,把气体通入澄清石灰水,石灰水变浑浊。根据上述现象判断:
(1)一定存在的物质是_______;一定不存在的物质是________;可能存在的物质是_____________;
(2)请写出白色沉淀部分溶解的化学方程式_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据合成氨反应的能量变化示意图,下列有关说法正确的是( )
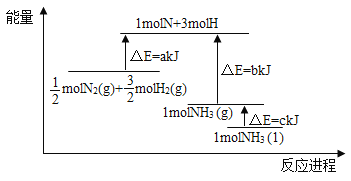
A. 若合成氨反应使用催化剂,反应放出的热量增多
B. 断裂0.5moIN2(g)和1.5molH2(g)中所有的化学键释放akJ热量
C. 2NH3(l)= N2(g)+3H2(g) △H=2(b+c-a) kJ/mol
D. N2(g)+3H2(g)=2NH3(g) △H=-2(a-b)kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com