
| A. | 0.5 L1mol/L NaHS溶液中,N(Na+)+N(HS-)=NA | |
| B. | 12.4g白磷(分子式为P4)中含有P-P共价键0.6NA | |
| C. | 常温下,pH=2的醋酸溶液中所含有的H+数为0.01NA | |
| D. | 将92gN2O4晶体放入容器中,恢复到常温常压时,所含气体分子数为NA |
分析 A.根据物料守恒判断,溶液中还存在硫化氢分子和硫离子;
B.白磷分子式为P4,是正四面体型结构,分子中含有6个P-P共价键;
C.强酸溶液体积,无法计算溶液中氢离子数目;
D.恢复到常温常压时,部分四氧化二氮转化成二氧化氮,气体分子数增大.
解答 解:A.0.5 L1mol/L NaHS溶液中含有溶质硫氢化钠0.5mol,根据物料守恒可得:N(Na+)+N(H2S)+N(S2-)+N(HS-)=NA,故A错误;
B.12.4 g白磷(分子式为P4)的物质的量是:$\frac{12.4g}{124g/mol}$=0.1mol,白磷分子中含有6个P-P共价键,则0.1mol白磷分子中含有0.6molP-P共价键,含有P-P共价键0.6 NA,故B正确;
C.没有告诉该醋酸溶液的体积,无法计算溶液中氢离子的数目,故C错误;
D.92g四氧化二氮的物质的量为:$\frac{92g}{92g/mol}$=1mol,N2O4在容器中存在平衡:N2O4?2NO2,所以将92 g N2O4晶体放入容器中,恢复到常温常压时,所含气体的物质的量大于1mol,气体分子数大于NA个,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;B为易错点,注意明确白磷分子的组成及结构.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3COOCH2CH3+H2O,该反应的类型为取代反应.
CH3COOCH2CH3+H2O,该反应的类型为取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
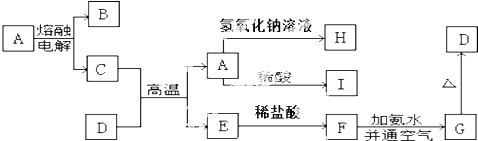
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入Cl2后,溶液变为黄色,加淀粉液后溶液变蓝,则原溶液中一定有I- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则原溶液中一定有SO42- | |
| C. | 加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,则原溶液中一定有CO32- | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
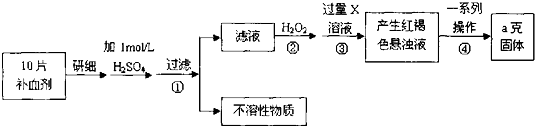
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3p3表示3p能级有三个轨道 | |
| B. | 基态碳原子的价电子排布图: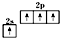 | |
| C. | 冰和固体碘晶体中相互作用力不完全相同 | |
| D. | 某气态团簇分子结构如图所示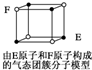 ,该气态团簇分子的分子式为EF或FE ,该气态团簇分子的分子式为EF或FE |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com