
【题目】氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g);△H=-905k/mol,4NH3(g)+3O2(g)
4NO(g)+6H2O(g);△H=-905k/mol,4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g);△H=-1268kj/mol。下列说法正确的是
2N2(g)+6H2O(g);△H=-1268kj/mol。下列说法正确的是
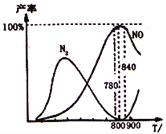
A. 工业上进行氨催化氧化生成NO时,温度应控制在780~840℃之间
B. 工业上采用物料比n(O2)/n(NH3)在1.7~2.0,主要是为了提高反应速率
C. 在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率
D. 氮气氧化为NO的热化学方程式为:N2(g)+O2(g)![]() 2NO(g)△H=-181.5kJ/mol
2NO(g)△H=-181.5kJ/mol
【答案】A
【解析】
A.图象分析判断,在780~840℃之间一氧化氮的产率接近100%,从转化率的大小与温度的关系选择反应的适宜温度;B.根据外界条件对氨催化氧化生成NO的化学平衡的影响分析C.反应是气体体积增大的反应,增大压强平衡向气体体积减小的方向进行;D.依据热化学方程式和 盖斯定律计算分析判断;
解析:
A.从图象可以看在,反应温度在780~840℃,NO的产率最大,故选择800℃左右,工业上进行氨催化氧化生成 NO时,温度应控制在780~840℃之间,故A正确;
B.4NH3(g)+5O2(g)4NO(g)+6H2O(g);△H=-905kJmol-1该反应是气体体积增大的、放热的反应,为了提高氨催化氧化生成NO的产率,需使化学平衡向正反应方向移动,可采取减小压强、降低温度、增大NH3的浓度,主要是提高一氧化氮的产率,故B错误;
C.反应是气体体积增大的反应,增大压强平衡向气体体积减小的方向进行,平衡逆向进行,反应物转化率减小,故C错误;
D.4NH3(g)+5O24NO(g)+6H2O(g);△H=-905kJ/mol①
4NH3(g)+3O2(g)2N2(g)+6H2O(g);△H=-1268kJ/mol②;
依据盖斯定律①-②得到,2N2(g)+2O2(g)=4NO(g)△H=+363KJ/mol,则氮气氧化为NO的热化学方程式为:N2(g)+O2(g)2NO(g);△H=+181.5 kJ/mol,故D错误;本题选A。


科目:高中化学 来源: 题型:
【题目】金合欢醇广泛应用于多种香型的香精中,其结构简式如图所示。下列说法不正确的是( )
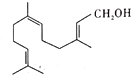
A.金合欢醇的同分异构体中不可能有芳香烃类
B.金合欢醇可发生加成反应、取代反应、氧化反应
C.金合欢醇分子的分子式为C15H26O
D.1 mol金合欢醇与足量Na反应生成0.5 mal氢气,与足量NaHCO3溶液反应生成1 mol CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
A.图表示反应2SO2 (g)+O2(g)![]() 2SO3 (g) ΔH<0不同温度(T1<T2)时平衡常数K随压强的变化关系图
2SO3 (g) ΔH<0不同温度(T1<T2)时平衡常数K随压强的变化关系图
B.图曲线表示电解精炼铜过程中电极质量的变化
C.图曲线表示反应N2(g)+3H2(g)![]() 2NH3(g)在t1时刻增大压强后v(正)、v(逆)随时间的变化
2NH3(g)在t1时刻增大压强后v(正)、v(逆)随时间的变化
D.图曲线表示0.1000 mol·L—1 NaOH溶液滴定20.00 mL pH=1的CH3COOH溶液所得溶液的pH随NaOH溶液体积的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为分离废磷酸亚铁锂电池的正极材料(主要含LiFePO4和铝箔)中的金属,将正极材料粉碎后进行如下流程所示的转化:

已知LiFePO4不溶于水和碱,能溶于强酸。
(1)“碱溶”时的离子方程式为___。
(2)向滤液Ⅰ中通入过量CO2会析出Al(OH)3沉淀,写出该反应的离子方程式:___。
(3)“酸浸”时溶液中Fe2+发生反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+4D反应中,表示该反应速率最快的是()
3C+4D反应中,表示该反应速率最快的是()
A.v(A)=0.5 mol/(L·min) B.v(B)=0.3 mol/(L·min)
C.v(C)=0.8 mol/(L·min) D.v(D)=1 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示曲线a和b是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是( )

A.P点时恰好完全反应,溶液呈中性
B.盐酸的物质的量浓度为1 mol·L-1
C.酚酞不能用作本实验的指示剂
D.曲线a是盐酸滴定氢氧化钠溶液的滴定曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu(OH)2在水溶液中存在着如下沉淀溶解平衡:Cu(OH)2(s) Cu2+(aq)+2OH-(aq),在常温下Ksp=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02mol/L的CuSO4溶液中加入碱来调整溶液的pH,应使溶液的pH大于( )
A.3B.4C.5D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个体积为5 L的真空密闭容器中加入1.25 mol CaCO3,发生反应CaCO3 (s)![]() CaO(s) +CO2(g),测得平衡时二氧化碳的物质的量浓度随温度的变化关系如图所示:
CaO(s) +CO2(g),测得平衡时二氧化碳的物质的量浓度随温度的变化关系如图所示:
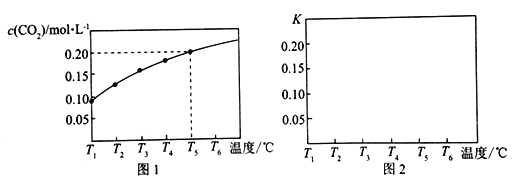
请按要求回答下列问题:
(1)该反应正反应为__________热反应(填“吸”或“放”),温度为T5℃时,该反应耗时40s达到平衡,则T5℃时,该反应的平均反应速率为________________。
(2)T2℃时,该反应已经达到平衡,下列措施中能使该反应的平衡常数K值变大的是_______________(选填编号)。
a.减小压强 b.减少CaO的量 c.加入CaCO3 d.升高温度
(3)请在如图中画出平衡常数K随温度的变化曲线_______________。
(4)在T5℃下,维持温度和容器体积不变,向上述平衡体系中再充入1molN2,则最后平衡时容器中的CaCO3的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能量的叙述不正确的是
A.H2(g)的燃烧热是H=-285.8kJ/mol,则反应2H2O(g)=2H2(g)+O2(g)的反应热H=+571.6kJ/mol
B.化学键的断裂和形成是物质在化学变化中能量变化的主要原因
C.活化能的大小对化学反应前后的能量变化不产生影响
D.化学反应过程中同时存在物质变化和能量的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com