
【题目】为分离废磷酸亚铁锂电池的正极材料(主要含LiFePO4和铝箔)中的金属,将正极材料粉碎后进行如下流程所示的转化:

已知LiFePO4不溶于水和碱,能溶于强酸。
(1)“碱溶”时的离子方程式为___。
(2)向滤液Ⅰ中通入过量CO2会析出Al(OH)3沉淀,写出该反应的离子方程式:___。
(3)“酸浸”时溶液中Fe2+发生反应的离子方程式为_____。
【答案】2Al+2OH-+2H2O=2AlO2-+3H2↑ AlO2-+2H2O+CO2=Al(OH)3↓+HCO3- 2Fe2++2H++H2O2=2Fe3++2H2O
【解析】
废磷酸亚铁锂电池的正极材料(主要含LiFePO4和铝箔),加入NaOH溶液,铝箔与NaOH溶液反应生成偏铝酸钠和水,所以滤液Ⅰ为NaAlO2,LiFePO4不溶于水和碱,所以滤渣Ⅰ为LiFePO4,LiFePO4能溶于强酸,加入H2SO4、H2O2,其中的Fe2+被氧化为Fe3+,加入NaOH溶液,生成Fe(OH)3沉淀,再加入Na2CO3溶液,Li+转化为Li2CO3沉淀,据此答题。
(1)“碱溶”时,正极材料粉末中的铝箔与NaOH溶液反应生成偏铝酸钠和水,化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)滤液Ⅰ为NaAlO2溶液,通入过量CO2会生成Al(OH)3沉淀,反应的化学方程式为:AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-;
(3)“酸浸”时溶液中的Fe2+在酸性条件下被H2O2氧化为Fe3+,反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O。


科目:高中化学 来源: 题型:
【题目】全钒氧化还原液流电池是一种新型绿色的二次电池。其工作原理如图所示。下列叙述正确的是
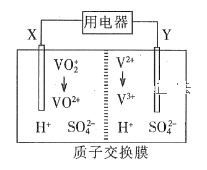
A.放电时,电子由Y极流出,经质子交换膜到X极
B.放电过程中,电解质溶液pH降低
C.充电时,X极反应式为:VO2++H2O -e- = VO2++2H+
D.放电时,每转移1 mol电子理论上有2 mol H+由交换膜右侧向左侧迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在一恒容密闭容器中,能表示反应 X(g)+2Y(g)![]() 2Z(g) 一定达到化学平衡状态的是( )
2Z(g) 一定达到化学平衡状态的是( )
①容器中气体的密度不再发生变化 ② X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
A.①②B.②③C.③④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a-Fe(III)晶面铁原子簇是合成氨工业的一种新型高效催化剂,N2和H2在其表面首先变为活化分子,反应机理为①H2 (g)=2H(g) △H1,②N2(g)+2H(g)2(NH)(g) △H2, ③(NH)(g)+H(g)![]() (NH2)(g) △H3, ④(NH2)(g)+H(g)
(NH2)(g) △H3, ④(NH2)(g)+H(g) ![]() NH3 (g) △H4,总反应为N2 (g)+3H2(g)
NH3 (g) △H4,总反应为N2 (g)+3H2(g)![]() 2NH3 (g) △H。下列说法正确的是
2NH3 (g) △H。下列说法正确的是
A. 催化剂能够有效降低反应的活化能和改变反应的焓变
B. 增大压强和使用高效催化剂均有利于提高总反应的平衡转化率
C. 反应①和总反应均为放热反应
D. △H=3△H1+△H2+2△H3+2△H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是
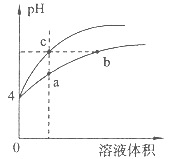
A. a、c两点溶液的导电能力相同
B. b点溶液中c(H+)+c(NH3·H2O)=c(OH-)
C. a、b、c三点溶液中水的电离程度a>b>c
D. 用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb=Vc
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量g/100ml![]() 。
。
(1)量取10.00ml食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液。
(2)用___(填仪器名称)取待测白醋溶液20.00ml于锥形瓶中,向其中滴加2滴酚酞。
(3)读取盛装0.1000mol/LNaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为___mL。滴定终点的现象:___,停止滴定,记录NaOH溶液的终读数,计算实验所用NaOH溶液总体积记录于下表,重复滴定4次。
![]()
(4)实验记录数据(ml)
滴定次数 | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH) | 15.95 | 15.00 | 15.05 | 14.95 |
(5)数据处理与讨论:
A.甲同学在处理数据时计算得:平均消耗的NaOH溶液的体积__ml,按正确数据处理,可得市售白醋总酸量![]() __g/100ml。
__g/100ml。
B.在本实验的滴定过程中,下列操作对实验结果的影响是(填写“偏大”、“偏小”或“无影响”)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗___;
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失___;
c.锥形瓶中加入待测白醋溶液后,再加少量水___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g);△H=-905k/mol,4NH3(g)+3O2(g)
4NO(g)+6H2O(g);△H=-905k/mol,4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g);△H=-1268kj/mol。下列说法正确的是
2N2(g)+6H2O(g);△H=-1268kj/mol。下列说法正确的是
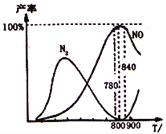
A. 工业上进行氨催化氧化生成NO时,温度应控制在780~840℃之间
B. 工业上采用物料比n(O2)/n(NH3)在1.7~2.0,主要是为了提高反应速率
C. 在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率
D. 氮气氧化为NO的热化学方程式为:N2(g)+O2(g)![]() 2NO(g)△H=-181.5kJ/mol
2NO(g)△H=-181.5kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盖斯定律指出:化学反应的焓变只与各反应物的始态和各生成物的终态有关,而与具体的反应途径无关。物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是( )(A→F从△H1递增到△H6)

A. A→F △H=-△H6 B. △H1+△H2+△H3+△H4+△H5+△H6=1
C. C→F ∣△H∣=∣△H1+△H2+△H6∣ D. ∣△H1+△H2+△H3∣=∣△H4+△H5+△H6∣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是298K时,N2与H2反应过程中能量变化的曲线图,下列叙述错误的是( )

A.在温度、体积一定的条件下,通入1mol N2和3mol H2反应后放出的热量为92kJ
B.a曲线是加入催化剂时的能量变化曲线,催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加
C.催化剂,能增大有效碰撞次数,但不能提高N2的转化率
D.该反应的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H= -92kJ/mol
2NH3(g) △H= -92kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com