
����Ŀ����ͼ��ʾ��298Kʱ��N2��H2��Ӧ�����������仯������ͼ����������������ǣ� ��

A.���¶ȡ����һ���������£�ͨ��1mol N2��3mol H2��Ӧ��ų�������Ϊ92kJ
B.a�����Ǽ������ʱ�������仯�����������ܽ��ͷ�Ӧ�Ļ�ܣ�ʹ��λ����ڻ���Ӱٷ����������
C.��������������Ч��ײ���������������N2��ת����
D.�÷�Ӧ���Ȼ�ѧ����ʽΪ��N2(g)+3H2(g)![]() 2NH3(g) ��H= -92kJ/mol
2NH3(g) ��H= -92kJ/mol
���𰸡�A
��������
A.���¶ȡ����һ���������£�N2��H2�ķ�ӦΪ���淴Ӧ��ͨ��1mol N2��3mol H2��Ӧ������ȫ���У���ų�������С��92kJ��A����
B.�����ܽ��ͷ�Ӧ�Ļ�ܣ�ʹ��λ����ڻ���Ӱٷ���������ӣ��Է�Ӧ���ʱ���Ӱ�죬a�����Ǽ������ʱ�������仯���ߣ�B��ȷ��
C.��������������Ч��ײ���������Ի�ѧƽ����ƶ���Ӱ�죬�������N2��ת���ʣ�C��ȷ��
D.����ͼ���֪���÷�Ӧ���Ȼ�ѧ����ʽΪ��N2(g)+3H2(g)![]() 2NH3(g)��H=��92kJ/mol��D��ȷ��
2NH3(g)��H=��92kJ/mol��D��ȷ��
��ΪA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ![]() ��һ���ܱ������н��У����д�ʩ����ʹ��Ӧ����������ǣ� ��
��һ���ܱ������н��У����д�ʩ����ʹ��Ӧ����������ǣ� ��
����������![]() �������¶Ȣ�������䣬��ͨ��
�������¶Ȣ�������䣬��ͨ��![]() ����С�������ѹǿ��������䣬��ͨ��He��ѹǿ���䣬��ͨ��He
����С�������ѹǿ��������䣬��ͨ��He��ѹǿ���䣬��ͨ��He
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̽�����������Ũ���ᷴӦ��װ�ã��̶�װ������ȥ������ͼ��ʾ������ʵ������������������
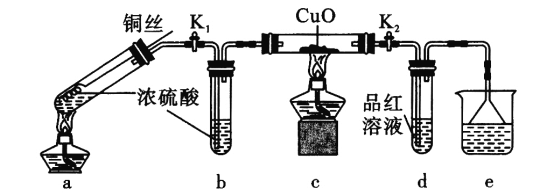
A.���³鶯ͭ˿,�ɿ��Ʒ�Ӧ��ʱ������ֹͣ
B.e�п���ѡ��NaOH��Һ������KMnO4��Һ
C.������������,����˿����ͭ˿��c��d������ʵ��������ͬ
D.Ϊȷ��a�а�ɫ�����Ƿ�������ͭ,������ȴ����Թ���ע��ˮ,��۲�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͭ�ܿ�ʯ��Ҫ����CoO(OH)��CoCO3��Cu2(OH)2CO3��SiO2����һ������Fe2O3��MgO��CaO�ȡ��ɸÿ�ʯ��Co2O3�IJ��ֹ���������ͼ��
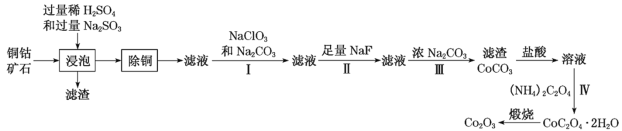
�ش��������⣺
��1���������������У���(III)��ת��ΪCoSO4��д����ת������ػ�ѧ����ʽ��__��
��2������ͭ����ѡ��MnS�����㳣���¸�����ͭ����Ӧ��ƽ�ⳣ��K=__���۱���2λ��Ч���֣���֪������Ksp(MnS)=2.5��10�C13��Ksp(CuS)=1.3��10�C36]
��3���ٲ���I�м���NaClO3��Fe2+��Ӧ�����ӷ���ʽΪ__��
�ڳ����£���Һ�н�������(Mn+)��pM��pM=�Clgc(Mn+)]����ҺpH�仯��ϵ��ͼ��ʾ�������NaClO3����Һ�е�c(Co2+)Ϊ0.1molL-1��������ͼ����������I�м���Na2CO3������ҺpH��ΧΪ__���۵�c(Mn+)��10�C6molL�C1������Ϊ�ý������ӳ�����ȫ]
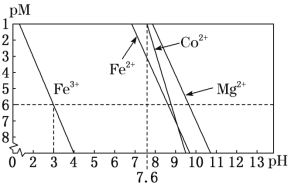
��4������II�м�������NaF��Ŀ����__��
��5�����˳���CoC2O42H2O���徭ϴ�Ӻ�֤��������ϴ���IJ���Ϊ__��
��6����ij������m1kg��ͭ�ܿ�ʯ�Ʊ���m2kgCo2O3���������Ϊa����ÿ�ʯ����Ԫ�صİٷֺ���Ϊ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��º�����ʹNH2COONH4 (s)![]() 2NH3 (g)+CO2(g)�ﵽƽ�⣬�������жϸ÷�Ӧ�ﵽ��ѧƽ����ǣ� ��
2NH3 (g)+CO2(g)�ﵽƽ�⣬�������жϸ÷�Ӧ�ﵽ��ѧƽ����ǣ� ��
A.V��(NH3) =2V��(CO2)
B.�ܱ������а����������������
C.�ܱ���������ѹǿ����
D.�ܱ������л��������ܶȲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴ӦN2��g��+3H2��g��![]() 2NH3��g����H��0�������о�Ŀ�ĺ�ʾ��ͼ�������
2NH3��g����H��0�������о�Ŀ�ĺ�ʾ��ͼ�������
A | B | C | D | |
�о�Ŀ�� | ѹǿ�Է�Ӧ��Ӱ��P2��P1 | �¶ȶԷ�Ӧ��Ӱ�� | ƽ����ϵ���ӵ����Է�Ӧ��Ӱ�� | �����Է�Ӧ��Ӱ�� |
ͼʾ |
|
|
|
|
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������A��Ϊ��״��ɫ���壬B��Ϊ����ɫ��ĩ��C��Ϊ��ɫ���塣����A��B��C����ͼ��ʾװ�����ӣ�������(��)(��)ʱ��D�������������������(��)(��)ʱ��D���������Ϩ�𣻹رջ���(��)ʱ��A�з�Ӧ����ֹͣ��
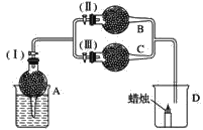
�Ը�������ʵ����ʵ���ش����¸����⣺
(1)A�з����Ļ�ѧ��Ӧ��______________��
(2)��װ��B�еĵ���ɫ��ĩ��______________��
(3)�ڸ����C�еİ�ɫ����ӦΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.300��ʱ����2mol A��2mol B������������2L�ܱ������У��������·�Ӧ��3A(g)��B(g)![]() 2C(g)��2D(g) ��H=Q��2minĩ�ﵽƽ�⣬����0.8mol D��
2C(g)��2D(g) ��H=Q��2minĩ�ﵽƽ�⣬����0.8mol D��
��1��300��ʱ���÷�Ӧ��ƽ�ⳣ������ʽΪK=___��֪K300��<K350��������H___0(����>������<��)��
��2����2minĩʱ��B��ƽ��Ũ��Ϊ____��D��ƽ����Ӧ����Ϊ___��
��3�����¶Ȳ��䣬��С�����ݻ�����A��ת����____(��������������С������������)��
II.A���ɵ��Ȳ����Ƴɵ��ܱ�������B��һ�ͻ�ѧ��ʴ�����ڴ��ȵ����ر�K2����������������NO2ͨ��K1��K3�ֱ����A��B�У���Ӧ��ʼʱ��A��B�������ͬ��
(��֪��2NO2![]() N2O4 ��H<0)
N2O4 ��H<0)
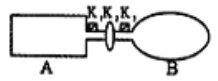
��1��һ��ʱ���Ӧ�ﵽƽ�⣬��ʱA��B�����ɵ�N2O4��������v(A)___(�>������<������=��)v(B)��������K2������B��___�����������С���������䡱����
��2�������£���A��B������������䣬��A���ϡ������Ȳ㣬B�������Խ����ȴ��ݣ���ﵽƽ��ʱ��___�е���ɫ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£����淴Ӧ��![]() ��ij�ܱ������дﵽƽ�⣬����˵������ȷ����
��ij�ܱ������дﵽƽ�⣬����˵������ȷ����
A.![]()
B.![]() ����Ӧ�ﵽƽ�⣬�����¶ȣ�������ƽ������
����Ӧ�ﵽƽ�⣬�����¶ȣ�������ƽ������
C.![]() �����ں�����ѹ�������������������粒������������
�����ں�����ѹ�������������������粒������������
D.![]() �����ܱ������дﵽƽ�⣬��������ƽ����Է����������䣬��Ӧһ���ﵽƽ��
�����ܱ������дﵽƽ�⣬��������ƽ����Է����������䣬��Ӧһ���ﵽƽ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com