
【题目】某铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,及一定量的Fe2O3、MgO和CaO等。由该矿石制Co2O3的部分工艺流程如图:
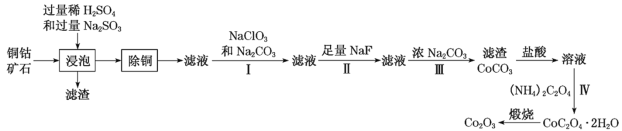
回答下列问题:
(1)“浸泡”过程中,钴(III)可转化为CoSO4,写出该转化的相关化学方程式:__。
(2)“除铜”若选用MnS,计算常温下该“除铜”反应的平衡常数K=__。[保留2位有效数字;已知常温下Ksp(MnS)=2.5×10–13,Ksp(CuS)=1.3×10–36]
(3)①步骤I中加入NaClO3与Fe2+反应的离子方程式为__。
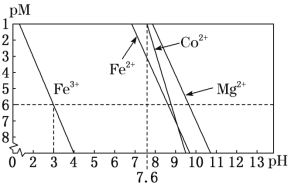
②常温下,溶液中金属离子(Mn+)的pM[pM=–lgc(Mn+)]随溶液pH变化关系如图所示,设加入NaClO3后,溶液中的c(Co2+)为0.1molL-1,依据如图分析,步骤I中加入Na2CO3调整溶液pH范围为__。[当c(Mn+)≤10–6molL–1,即认为该金属离子沉淀完全]
(4)步骤II中加入足量NaF的目的是__。
(5)过滤出的CoC2O42H2O固体经洗涤后,证明固体已洗净的操作为__。
(6)若某工厂用m1kg该铜钴矿石制备了m2kgCo2O3,假设产率为a,则该矿石中钴元素的百分含量为__。
【答案】2CoO(OH)+2H2SO4+Na2SO3=2CoSO4+Na2SO4+3H2O 1.9×1023 ClO![]() +6Fe2++6H+=Cl-+6Fe3++3H2O 3~7.6(或3≤pH<7.6) 形成沉淀,除去溶液中钙、镁离子 取少量最后一次洗涤液于试管中,加入硝酸酸化的硝酸银溶液,若无白色沉淀产生,则证明已洗净
+6Fe2++6H+=Cl-+6Fe3++3H2O 3~7.6(或3≤pH<7.6) 形成沉淀,除去溶液中钙、镁离子 取少量最后一次洗涤液于试管中,加入硝酸酸化的硝酸银溶液,若无白色沉淀产生,则证明已洗净 ![]() %
%
【解析】
铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,及一定量的Fe2O3、MgO和CaO等,由流程可知,加入过量稀硫酸和Na2SO3,可得Co2+、Cu2+、Fe2+、Mg2+、Ca2+,加入的Na2SO3主要是将Co3+、Fe3+还原为Co2+、Fe2+,加MnS可沉铜,然后加入NaClO3将Fe2+氧化为Fe3+,加入Na2CO3调pH,可以使Fe3+沉淀,过滤后所得滤液主要含有Co2+、Mg2+、Ca2+,再用NaF溶液除去钙、镁离子,过滤后,向滤液中加入浓Na2CO3溶液转为CoCO3固体,溶于盐酸后加入草酸铵溶液得到草酸钴晶体,煅烧后制得Co2O3。
(1)“浸泡”过程中,钴(III)可转化为CoSO4,该转化的相关化学方程式:2CoO(OH)+2H2SO4+Na2SO3=2CoSO4+Na2SO4+3H2O。故答案为:2CoO(OH)+2H2SO4+Na2SO3=2CoSO4+Na2SO4+3H2O;
(2)“除铜”若选用MnS,发生MnS+Cu2+![]() CuS+Mn2+,常温下该“除铜”反应的平衡常数K=
CuS+Mn2+,常温下该“除铜”反应的平衡常数K=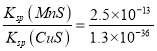 =1.9×1023,故答案为:1.9×1023;
=1.9×1023,故答案为:1.9×1023;
(3)①步骤I中加入NaClO3与Fe2+反应,生成Cl-和Fe3+,离子方程式为ClO![]() +6Fe2++6H+=Cl-+6Fe3++3H2O。故答案为:ClO
+6Fe2++6H+=Cl-+6Fe3++3H2O。故答案为:ClO![]() +6Fe2++6H+=Cl-+6Fe3++3H2O;
+6Fe2++6H+=Cl-+6Fe3++3H2O;
②设加入NaClO3后,溶液中的c(Co2+)为0.1molL-1,依据如图分析,pH>3时Fe3+完全沉淀,使CO2+不转化为沉淀,pH<7.6即可,步骤I中加入Na2CO3调整溶液pH范围为3~7.6(或3≤pH<7.6)。[当c(Mn+)≤10–6molL–1,即认为该金属离子沉淀完全]。故答案为:3~7.6(或3≤pH<7.6);
(4)步骤II中加入足量NaF的目的是形成沉淀,除去溶液中钙、镁离子。故答案为:形成沉淀,除去溶液中钙、镁离子;
(5)过滤出的CoC2O42H2O固体经洗涤后,检验洗涤液是否含有Cl-,证明固体已洗净的操作为:取少量最后一次洗涤液于试管中,加入硝酸酸化的硝酸银溶液,若无白色沉淀产生,则证明已洗净。故答案为:取少量最后一次洗涤液于试管中,加入硝酸酸化的硝酸银溶液,若无白色沉淀产生,则证明已洗净;
(6)若某工厂用m1kg该铜钴矿石制备了m2kg Co2O3,假设产率为a,设该矿石中钴元素的百分含量为x,由原子守恒可知m1kg×x×a×![]() =m2kg,解得x=
=m2kg,解得x=![]() %。故答案为:
%。故答案为:![]() %。
%。


科目:高中化学 来源: 题型:
【题目】填空:
(1)相同物质的量的二氧化硫和三氧化硫,所含分子的数目之比为__,所含原子数目之比为__,所含氧原子的物质的量之比为__,它们的质量之比为__。
(2)相同质量的二氧化硫和三氧化硫,所含分子的数目之比为_,所含原子数目之比为_,所含氧原子的物质的量之比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,1mol化学键断裂形成气态原子所需要的能量用![]() 表示。结合表中信息判断下列说法不正确的是( )
表示。结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ/mol) | 436 | 157 | 568 | 432 | 298 |
A. 432kJ/mol>E(H-Br)>298kJ/mol B. 表中最稳定的共价键是H-F键
C. H2(g)→2H(g) △H=+436kJ/mol D. H2(g)+F2(g)=2HF(g) △H=-25kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下浓度为0.1mol/L的几种溶液的pH如右下表。下列有关说法正确的是( )
溶质 | pH |
NaF | 7.5 |
Na2CO3 | 11.6 |
NaClO | 9.7 |
NaHCO3 | 8.3 |
A. 同温度同浓度下,酸由强到弱的顺序为:HF>H2CO3>HClO
B. 水解方程式:F-+H2O![]() HF+OH-的平衡常数为1×10-13
HF+OH-的平衡常数为1×10-13
C. 将CO2通入0.lmol/LNa2CO3溶液至溶液呈中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1mol/L
D. 等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(HF)>c(Na+)>c(F-)>c (H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量为0.10mol的镁条在只含有CO2和O2的容器中燃烧(产物不含碳酸镁,不考虑C与O2的反应),反应后容器内固体物质的质量不可能为( )
A.3.2g
B.4.0g
C.4.2g
D.4.7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环氧乙烷常用于一次性口罩生产过程中灭菌和新冠病毒的消杀,工业上常利用乙烯直接氧化法生产环氧乙烷(![]() ),发生的反应如下。
),发生的反应如下。
主反应Ⅰ:2CH2=CH2(g)+O2(g)![]() 2
2![]() (g) ΔH1=-210kJ·mol-1
(g) ΔH1=-210kJ·mol-1
副反应Ⅱ:CH2=CH2(g)+3O2(g)![]() 2CO2(g)+2H2O(l) ΔH2=-1324kJ·mol-1
2CO2(g)+2H2O(l) ΔH2=-1324kJ·mol-1
副反应Ⅲ:2![]() (g)+5O2(g)
(g)+5O2(g)![]() 4CO2(g)+4H2O(g) ΔH3
4CO2(g)+4H2O(g) ΔH3
已知:环氧乙烷选择性是指乙烯进行反应Ⅰ生成环氧乙烷的优势。
(1)ΔH3=__kJ·mol-1。
(2)①图1是乙烯转化率、环氧乙烷选择性与流速关系的图象,图中随进料气的流速加快,乙烯的转化率下降,其可能原因是__。
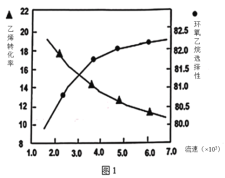
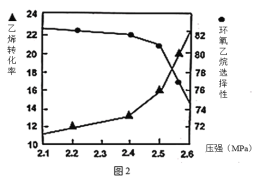
②图2是乙烯转化率、环氧乙烷选择性与压强关系的图象,图中当反应体系的压强高于2.4MPa,环氧乙烷选择性下降,其可能原因是__。
(3)实验测得反应Ⅰ中,υ正=K正·x2(CH2=CH2)·x(O2),υ逆=K逆·x2(![]() ),(式中x为物质的量分数;K正、K逆为速率常数,只与温度有关)。
),(式中x为物质的量分数;K正、K逆为速率常数,只与温度有关)。
①若在1L的密闭容器中充2molCH2=CH2(g)和1molO2(g),在一定温度下只发生反应I,达到平衡时CH2=CH2的转化率为75%,则该反应平衡常数的值为__。
②若平衡后仅升高温度,则下列说法正确的是___。
A.x(CH2=CH2)增大,x(![]() )减小
)减小
B.K正与K逆的比值增大
C.υ正减小,υ逆增大
D.K正与K逆的比值减小
(4)将乙烯与饱和食盐水的电解产物反应,转化为氯乙醇[CH2(OH)CH2Cl],氯乙醇进一步反应生成环氧乙烷,其电解简易装置如图所示。
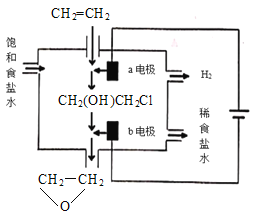
已知:CH2=CH2+H2O+Cl2→CH2(OH)CH2Cl+HCl
①a电极为__(选填“阴极”或“阳极”),其电极反应式为:__。
②b电极区域生成环氧乙烷的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是298K时,N2与H2反应过程中能量变化的曲线图,下列叙述错误的是( )

A.在温度、体积一定的条件下,通入1mol N2和3mol H2反应后放出的热量为92kJ
B.a曲线是加入催化剂时的能量变化曲线,催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加
C.催化剂,能增大有效碰撞次数,但不能提高N2的转化率
D.该反应的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H= -92kJ/mol
2NH3(g) △H= -92kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知:
①反应C+G![]() B+H能放出大量的热,该反应曾应用于铁轨的焊接;
B+H能放出大量的热,该反应曾应用于铁轨的焊接;
②I是一种常见的温室气体,它和E可以发生反应:2E+I![]() 2F+D,F中E元素的质量分数为60%。
2F+D,F中E元素的质量分数为60%。
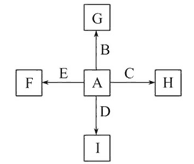
回答问题:
(1)①中反应的化学方程式为:________________________________________;
(2)1.6 g G溶于盐酸,得到的溶液与铜粉完全反应,计算至少需铜粉的质量(写出离子方程式和计算过程);__________________________________________。
(3)C与过量NaOH溶液反应的离子方程式为:___________________________,反应后溶液与过量化合物I反应的离子方程式为:_________________________;
(4)E在I中燃烧观察到的现象是:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法,不正确的是( )
A.ClO2具有强氧化性,可用于自来水的杀菌消毒
B.氮肥包括铵态氮肥、硝态氮肥和尿素
C.电解法冶炼铝时,加入冰晶石可降低氧化铝熔融温度,减少能耗
D.生物炼铜,是指在某些细菌作用下,利用空气中的氧气将不溶性铜矿转化为铜单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com