
【题目】物质的量为0.10mol的镁条在只含有CO2和O2的容器中燃烧(产物不含碳酸镁,不考虑C与O2的反应),反应后容器内固体物质的质量不可能为( )
A.3.2g
B.4.0g
C.4.2g
D.4.7g
科目:高中化学 来源: 题型:
【题目】 运用化学反应原理研究碳、氮、硫的化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)有科学家经过研究发现,用CO2和H2在210~ 290℃, 催化剂条件下可转化生成甲醇蒸汽和水蒸气。230℃,向容器中投入0.5mol CO2和1.5mol H2.当CO2平衡转化率达80%时放出的热量为19. 6kJ,写出该反应的热化学方程式∶___________。
(2)在2L密闭容器中,起始投人4mol CO和6mol H2,在一定条件下发生反应CO(g)+2H2(g)![]() CH3OH(g),平衡时仅改变温度测得的数据如下表所示∶ (已知:T1<T2)
CH3OH(g),平衡时仅改变温度测得的数据如下表所示∶ (已知:T1<T2)
温度/℃ | 平衡时CH3OH的物质的量/ mol | 化学平衡常数 |
T1 | 2.6 | K1 |
T2 | 2.0 | K2 |
①则K1_______(填“>”“<”或“=”) K2,原因是_________________。
②在T2下,经过10s达到化学平衡状态,则0~ 10s内H2的平均速率v(H2)为_______,若维持条件不变再向容器中充入CO、H2和CH3OH各1mol,则v正_________(填“>”“<”或“=”)v逆。
(3)某科研小组设计的一个氮氧化物原电池 ,两边的阴影部分为 a、b惰性电极,分别用导线与烧杯的m、n惰性电极相连接,工作原理如图:

①b极的电极反应式为_______________________。
②当有0.2mol O2-通过固体电解质时,则烧杯中m处的产物的物质的量为________。
(4)处理烟气中SO2,也可采用碱液吸收法,已知25°C时,K(NH3 H2O)=1.8×10-5; Kcp(CaSO4)=7.1×10-5.
第1步∶用过量的浓氨水吸收SO2,并在空气中氧化;
第2步∶加入石灰水,发生反应![]() K。计算第2步中反应的K=_____________(列出计算式即可)。
K。计算第2步中反应的K=_____________(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚酯类高分子化合物F,因其优异的耐热性和良好的力学性能而得到广泛的应用,合成路线如下:

已知:
回答下列问题:
(1)A中含有的含氧官能团的电子式为_______,A→B的反应类型为_____。
(2)E在一定条件下还可以合成含有六元环状结构的G,则G的结构简式为_________。
(3)D→E转化反应①的化学方程式是_______。
(4)E生成F反应的化学方程式是______。
(5)若F的平均相对分子质量为25890,则其平均聚合度为______ 。
(6)满足下列条件的C的同分异构体有____种(不考虑立体异构)。
①含有1个六元碳环,且环上相邻4个碳原子上各连有一个取代基 ②1mol该物质与新制的Cu(OH)2悬浊液反应产生2mol砖红色沉淀
(7)写出以![]() 为原料(其他试剂任选)制备化合物
为原料(其他试剂任选)制备化合物 的合成路线______。
的合成路线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究金属与过量浓硫酸反应的装置(固定装置已略去)如下图所示。关于实验操作或叙述错误的是
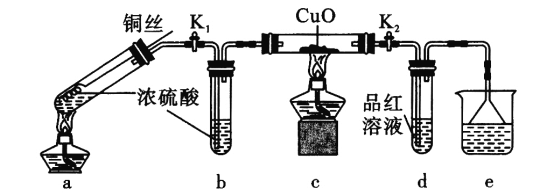
A.上下抽动铜丝,可控制反应随时发生或停止
B.e中可以选用NaOH溶液或酸性KMnO4溶液
C.其他条件不变,用铁丝代替铜丝,c、d中两次实验现象相同
D.为确定a中白色固体是否是硫酸铜,可向冷却后的试管中注入水,振荡后观察现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的化合物在工业上应用广泛,下面有几种碳的化合物的具体应用:
(1)已知下列热化学方程式:
i. CH2=CHCH3(g)+ Cl2(g)=CH2ClCHClCH3(g) △H1= -133 kJ·mol-1
ii. CH2=CHCH3(g)+Cl2(g)=CH2 =CHCH2Cl(g)+HCl(g) △H2= -100 kJ·mol-1
又已知在相同条件下,CH2=CHCH2Cl(g)+HCl(g)=CH2ClCHClCH3(g) 的正反应的活化能Ea(正)为132 kJmol-1,则逆反应的活化能Ea(逆)为________kJmol-1。
(2)查阅资料得知,反应CH3CHO(aq)=CH4(g)+CO(g)在含有少量I2的溶液中分两步进行:
第I步反应为CH3CHO(aq)+I2(aq)→CH3I(l) +HI(aq)+CO(g)(慢反应);
第II步为快反应。增大I2的浓度________(填“能”或“ 不能”)明显增大总反应的平均速率,理由为______________。
(3)用催化剂Fe3(CO)12/ZSM -5催化CO2加氢合成乙烯的反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。

催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。

欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM -5中添加__________助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是__________________。
(4)在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S):n(CH4) =2:1,发生反应:CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)。0. 11MPa时,温度变化对平衡时产物的物质的量分数的影响如下图所示:
CS2(g)+4H2(g)。0. 11MPa时,温度变化对平衡时产物的物质的量分数的影响如下图所示:

为提高H2S的平衡转化率,除改变温度外,还可采取的措施是______________(列举一条)。N点对应温度下,该反应的Kp=______ ( MPa)2(Kp为以分压表示的平衡常数)。
(5)合成碳酸二甲酯的工作原理如下图所示。

阳极的电极反应式为_______,离子交换膜a为__________(填“阳膜”、“阴膜”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,及一定量的Fe2O3、MgO和CaO等。由该矿石制Co2O3的部分工艺流程如图:
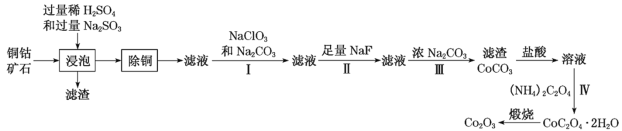
回答下列问题:
(1)“浸泡”过程中,钴(III)可转化为CoSO4,写出该转化的相关化学方程式:__。
(2)“除铜”若选用MnS,计算常温下该“除铜”反应的平衡常数K=__。[保留2位有效数字;已知常温下Ksp(MnS)=2.5×10–13,Ksp(CuS)=1.3×10–36]
(3)①步骤I中加入NaClO3与Fe2+反应的离子方程式为__。
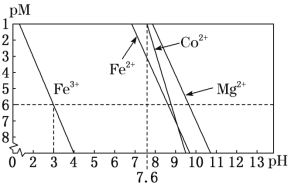
②常温下,溶液中金属离子(Mn+)的pM[pM=–lgc(Mn+)]随溶液pH变化关系如图所示,设加入NaClO3后,溶液中的c(Co2+)为0.1molL-1,依据如图分析,步骤I中加入Na2CO3调整溶液pH范围为__。[当c(Mn+)≤10–6molL–1,即认为该金属离子沉淀完全]
(4)步骤II中加入足量NaF的目的是__。
(5)过滤出的CoC2O42H2O固体经洗涤后,证明固体已洗净的操作为__。
(6)若某工厂用m1kg该铜钴矿石制备了m2kgCo2O3,假设产率为a,则该矿石中钴元素的百分含量为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容下使NH2COONH4 (s)![]() 2NH3 (g)+CO2(g)达到平衡,不可以判断该反应达到化学平衡的是( )
2NH3 (g)+CO2(g)达到平衡,不可以判断该反应达到化学平衡的是( )
A.V正(NH3) =2V逆(CO2)
B.密闭容器中氨气的体积分数不变
C.密闭容器中总压强不变
D.密闭容器中混合气体的密度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】干燥管A中为块状白色固体,B中为淡黄色粉末,C中为白色固体。并将A、B、C按如图所示装置连接,当打开活塞(Ⅰ)(Ⅱ)时,D中蜡烛火焰明亮;打开活塞(Ⅰ)(Ⅲ)时,D中蜡烛火焰熄灭;关闭活塞(Ⅰ)时,A中反应自行停止。
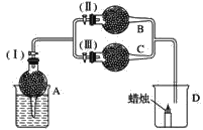
试根据上述实验事实,回答以下各问题:
(1)A中发生的化学反应是______________。
(2)在装置B中的淡黄色粉末是______________。
(3)在干燥管C中的白色固体应为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合气体由一种气态烷烃和一种气态烯烃(含一个双键)组成,在同温同压下,混合气体对氢气的相对密度13,在标准状况下,将56L混合气体通入足量的溴水中,溴水的质量增重35g。
(1)计算确定混合气体中烃的化学式_____。
(2)混合气体中两种烃的物质的量之比_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com