
【题目】 运用化学反应原理研究碳、氮、硫的化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)有科学家经过研究发现,用CO2和H2在210~ 290℃, 催化剂条件下可转化生成甲醇蒸汽和水蒸气。230℃,向容器中投入0.5mol CO2和1.5mol H2.当CO2平衡转化率达80%时放出的热量为19. 6kJ,写出该反应的热化学方程式∶___________。
(2)在2L密闭容器中,起始投人4mol CO和6mol H2,在一定条件下发生反应CO(g)+2H2(g)![]() CH3OH(g),平衡时仅改变温度测得的数据如下表所示∶ (已知:T1<T2)
CH3OH(g),平衡时仅改变温度测得的数据如下表所示∶ (已知:T1<T2)
温度/℃ | 平衡时CH3OH的物质的量/ mol | 化学平衡常数 |
T1 | 2.6 | K1 |
T2 | 2.0 | K2 |
①则K1_______(填“>”“<”或“=”) K2,原因是_________________。
②在T2下,经过10s达到化学平衡状态,则0~ 10s内H2的平均速率v(H2)为_______,若维持条件不变再向容器中充入CO、H2和CH3OH各1mol,则v正_________(填“>”“<”或“=”)v逆。
(3)某科研小组设计的一个氮氧化物原电池 ,两边的阴影部分为 a、b惰性电极,分别用导线与烧杯的m、n惰性电极相连接,工作原理如图:

①b极的电极反应式为_______________________。
②当有0.2mol O2-通过固体电解质时,则烧杯中m处的产物的物质的量为________。
(4)处理烟气中SO2,也可采用碱液吸收法,已知25°C时,K(NH3 H2O)=1.8×10-5; Kcp(CaSO4)=7.1×10-5.
第1步∶用过量的浓氨水吸收SO2,并在空气中氧化;
第2步∶加入石灰水,发生反应![]() K。计算第2步中反应的K=_____________(列出计算式即可)。
K。计算第2步中反应的K=_____________(列出计算式即可)。
【答案】![]() > 温度升高,n(CH3OH)减小,平衡逆向移动,H<0,温度升高K减小 0.2mol(Ls) <
> 温度升高,n(CH3OH)减小,平衡逆向移动,H<0,温度升高K减小 0.2mol(Ls) < ![]() 0.1mol
0.1mol 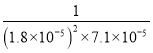
【解析】
根据物质的量与焓变的关系,换算成1mol二氧化碳气体发生反应放出的热量,注意水为气体,写出反应的热化学方程式。温度越高,甲醇的物质的量越小,平衡逆向移动,△H<0,从而比较出K的大小。列出三段式,根据平均速率公式v![]() 进行计算,用Qc和K值的大小判断平衡移动的方向。根据化合价的变化,判断出正负极,根据电极反应计算出m处的产物的物质的量。根据化学平衡常数、电离平衡常数、溶度积进行计算。
进行计算,用Qc和K值的大小判断平衡移动的方向。根据化合价的变化,判断出正负极,根据电极反应计算出m处的产物的物质的量。根据化学平衡常数、电离平衡常数、溶度积进行计算。
(1)发生反应∶![]() ,已知,0.5mol CO2转化率达80%时放热19.6kJ,即0.5mol×80%=0.4mol,0.4mol CO2放热19.6kJ,计算lmol二氧化碳发生反应放出的热量为49kJ,从而确定△H,写出热化学方程式为:
,已知,0.5mol CO2转化率达80%时放热19.6kJ,即0.5mol×80%=0.4mol,0.4mol CO2放热19.6kJ,计算lmol二氧化碳发生反应放出的热量为49kJ,从而确定△H,写出热化学方程式为:![]() ;
;
(2)①已知:T1<T2,根据表格数据,温度升高,n(CH3OH)在减小,平衡逆向移动,△H<0,温度升高K在减小,K1>K2;
②在T2下,经过l0s达到化学平衡状态。根据“三段式”∶

则0~10s内H2的平均速率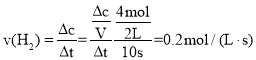 ,
,
若再同时增加各物质的量为1mol
K ,
,
Qc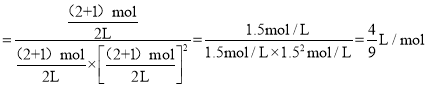 <K, 平衡正向移动,v正>v逆;
<K, 平衡正向移动,v正>v逆;
(3)①如图所示,氧气在电极a由0价变为-2价,化合价降低得电子,a为正极,b极中NO变为NO2,氨的化合价由+2价变为+4价,化合价升高失电子,b为负极,电极反应式为![]() ;
;
②根据:![]() ,当有0.2molO2-通过固体电解质时,转移0.4mol电子。原电池正极与电解池阳极相连,a为正极,m为阳极,电解池中,水在阳极失电子,电极反应式为
,当有0.2molO2-通过固体电解质时,转移0.4mol电子。原电池正极与电解池阳极相连,a为正极,m为阳极,电解池中,水在阳极失电子,电极反应式为![]() ,根据电极式,转移0.4mol电子生成0.1mol O2;
,根据电极式,转移0.4mol电子生成0.1mol O2;
(4)根据Kb=![]() ,Ksp=c(Ca2+) c(SO42-),反应
,Ksp=c(Ca2+) c(SO42-),反应![]() 的化学平衡常数
的化学平衡常数
 。
。


科目:高中化学 来源: 题型:
【题目】Ⅰ、钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050 |
沸点/℃ | 892 | 444.6 | 2980 |
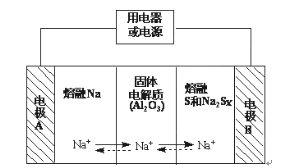
(1)请判断该电池工作的适宜温度应控制在____范围内(填字母序号)。
A.常温 B.60℃~ 100℃ C.200℃~350℃ D.2000℃~3000℃
(2)放电时,电极A为___极。
(3)放电时,内电路中Na+的移动方向为___(填“从A到B”或“从B到A”)。
(4)充电时,总反应为Na2Sx=2Na+xS(3<x<5),则阳极的电极反应式为___。
Ⅱ、用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示。(电极材料为石墨)
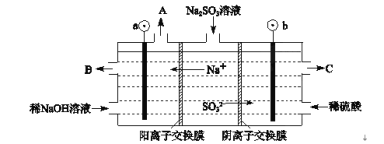
(1)图中a极要连接电源的(填“正”或“负”)___极,C口流出的物质是___。
(2)SO32-放电的电极反应式为____。
(3)电解过程中阴极区碱性明显增强,请结合电极方程式解释原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1mol AlN需转移3mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(1)参加反应的HNO3和作为氧化剂的HNO3的个数比为________。
(2)若有64 g Cu被氧化,则被还原的HNO3的质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应4 NH3(g)+5O2(g)![]() 4NO(g)+6 H2O(g),下列叙述正确的是
4NO(g)+6 H2O(g),下列叙述正确的是
A.NH3和H2O化学反应速率关系是2v正(NH3)= 3v正(H2O)
B.达到化学平衡时,4v正(O2)= 5v逆(NO )
C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空:
(1)相同物质的量的二氧化硫和三氧化硫,所含分子的数目之比为__,所含原子数目之比为__,所含氧原子的物质的量之比为__,它们的质量之比为__。
(2)相同质量的二氧化硫和三氧化硫,所含分子的数目之比为_,所含原子数目之比为_,所含氧原子的物质的量之比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液温度。
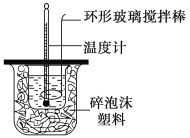
回答下列问题:
(1)倒入NaOH溶液的正确操作是________(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.用温度计小心搅拌
B.揭开泡沫塑料板用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地上下搅动
(3)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为__________________。
(4)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生记录数据如下:
实验序号 | 起始温度t1/ ℃ | 终止温度t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=________(结果保留一位小数)。
(5)________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述中不正确的是( )

A. 若A为醋酸,B为贝壳(粉状),C为澄清石灰水溶液,则C中溶液变浑浊
B. 若A为浓盐酸,B为锌粒,C中盛滴有酚酞的NaOH溶液,则C中溶液褪色
C. 若A为双氧水,B为MnO2,C中为NaOH溶液,D为防倒吸装置
D. 实验中仪器D可起到防倒吸的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量为0.10mol的镁条在只含有CO2和O2的容器中燃烧(产物不含碳酸镁,不考虑C与O2的反应),反应后容器内固体物质的质量不可能为( )
A.3.2g
B.4.0g
C.4.2g
D.4.7g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com