
【题目】氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1mol AlN需转移3mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41g
科目:高中化学 来源: 题型:
【题目】用惰性电极电解一定量的硫酸铜溶液,实验装置如图甲。电解过程中的实验数据如图乙,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。则下列说法不正确的是
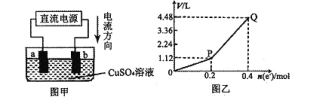
A.电解过程中,a电极表面先有红色物质析出,后有气泡产生
B.b电极上发生的反应方程式为:4OH-一4e-=2H2O+O2↑
C.曲线O一P段表示H2的体积变化
D.Q点时收集到的混合气体中H2和O2体积比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2A(g)+B(g)![]() 3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )

A. 图Ⅰ表示的是t1时刻增大反应物的浓度对反应速率的影响
B. 图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响
C. 图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将70g过氧化钠和氧化钠混合物与98g水充分反应,所得溶液恰好能被含硫酸98g的酸溶液中和,求:
(1)原混合物中过氧化钠和氧化钠的质量分别是多少?___
(2)所得氢氧化钠溶液的质量分数是多少?___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应,X2++Z=X+Z2+,Y+Z2+=Y2++Z。这四种离子被还原成0价时,表现的氧化性强弱顺序为( )
A.R2+>X2+>Z2+>Y2+B.X2+>R2+>Y2+>Z2+
C.Y2+>Z2+>R2+>X2+D.Z2+>X2+>R2+>Y2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】功能高分子P的合成路线如下:

(1)A的分子式是C7H8,其结构简式是___________________。
(2)试剂a是_______________。
(3)反应③的化学方程式:_______________。
(4)E的分子式是C6H10O2。E中含有的官能团:_______________。
(5)反应④的反应类型是_______________。
(6)反应⑤的化学方程式:_______________。
(5)已知:2CH3CHO 。
。
以乙烯为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 运用化学反应原理研究碳、氮、硫的化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)有科学家经过研究发现,用CO2和H2在210~ 290℃, 催化剂条件下可转化生成甲醇蒸汽和水蒸气。230℃,向容器中投入0.5mol CO2和1.5mol H2.当CO2平衡转化率达80%时放出的热量为19. 6kJ,写出该反应的热化学方程式∶___________。
(2)在2L密闭容器中,起始投人4mol CO和6mol H2,在一定条件下发生反应CO(g)+2H2(g)![]() CH3OH(g),平衡时仅改变温度测得的数据如下表所示∶ (已知:T1<T2)
CH3OH(g),平衡时仅改变温度测得的数据如下表所示∶ (已知:T1<T2)
温度/℃ | 平衡时CH3OH的物质的量/ mol | 化学平衡常数 |
T1 | 2.6 | K1 |
T2 | 2.0 | K2 |
①则K1_______(填“>”“<”或“=”) K2,原因是_________________。
②在T2下,经过10s达到化学平衡状态,则0~ 10s内H2的平均速率v(H2)为_______,若维持条件不变再向容器中充入CO、H2和CH3OH各1mol,则v正_________(填“>”“<”或“=”)v逆。
(3)某科研小组设计的一个氮氧化物原电池 ,两边的阴影部分为 a、b惰性电极,分别用导线与烧杯的m、n惰性电极相连接,工作原理如图:

①b极的电极反应式为_______________________。
②当有0.2mol O2-通过固体电解质时,则烧杯中m处的产物的物质的量为________。
(4)处理烟气中SO2,也可采用碱液吸收法,已知25°C时,K(NH3 H2O)=1.8×10-5; Kcp(CaSO4)=7.1×10-5.
第1步∶用过量的浓氨水吸收SO2,并在空气中氧化;
第2步∶加入石灰水,发生反应![]() K。计算第2步中反应的K=_____________(列出计算式即可)。
K。计算第2步中反应的K=_____________(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚酯类高分子化合物F,因其优异的耐热性和良好的力学性能而得到广泛的应用,合成路线如下:

已知:
回答下列问题:
(1)A中含有的含氧官能团的电子式为_______,A→B的反应类型为_____。
(2)E在一定条件下还可以合成含有六元环状结构的G,则G的结构简式为_________。
(3)D→E转化反应①的化学方程式是_______。
(4)E生成F反应的化学方程式是______。
(5)若F的平均相对分子质量为25890,则其平均聚合度为______ 。
(6)满足下列条件的C的同分异构体有____种(不考虑立体异构)。
①含有1个六元碳环,且环上相邻4个碳原子上各连有一个取代基 ②1mol该物质与新制的Cu(OH)2悬浊液反应产生2mol砖红色沉淀
(7)写出以![]() 为原料(其他试剂任选)制备化合物
为原料(其他试剂任选)制备化合物 的合成路线______。
的合成路线______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com