
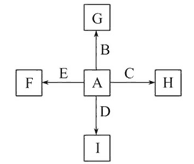
【题目】如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知:
①反应C+G![]() B+H能放出大量的热,该反应曾应用于铁轨的焊接;
B+H能放出大量的热,该反应曾应用于铁轨的焊接;
②I是一种常见的温室气体,它和E可以发生反应:2E+I![]() 2F+D,F中E元素的质量分数为60%。
2F+D,F中E元素的质量分数为60%。
回答问题:
(1)①中反应的化学方程式为:________________________________________;
(2)1.6 g G溶于盐酸,得到的溶液与铜粉完全反应,计算至少需铜粉的质量(写出离子方程式和计算过程);__________________________________________。
(3)C与过量NaOH溶液反应的离子方程式为:___________________________,反应后溶液与过量化合物I反应的离子方程式为:_________________________;
(4)E在I中燃烧观察到的现象是:____________________________________。
【答案】![]()
![]()
![]()
![]() ,至少需铜粉的质量为0.01 mol×64 g/mol=0.64 g
,至少需铜粉的质量为0.01 mol×64 g/mol=0.64 g ![]()
![]() 镁条剧烈燃烧,生成白色粉末,反应器内壁附着黑色固体
镁条剧烈燃烧,生成白色粉末,反应器内壁附着黑色固体
【解析】
图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的化合物,已知:①反应C+G![]() B+H能放出大量的热,该反应曾应用于铁轨的焊接,发生的是铝热反应,则C为Al,B为Fe,G为Fe2O3,H为Al2O3,推断A为O2,;
B+H能放出大量的热,该反应曾应用于铁轨的焊接,发生的是铝热反应,则C为Al,B为Fe,G为Fe2O3,H为Al2O3,推断A为O2,;
②I是一种常见的温室气体为CO2,它和E可以发生反应:2E+I![]() 2F+D,推断E为Mg,F为MgO,D为C,计算F中的E元素的质量分数=
2F+D,推断E为Mg,F为MgO,D为C,计算F中的E元素的质量分数=![]() ×100%=60%,符合;然后结合元素化合物知识及化学用语来解答。
×100%=60%,符合;然后结合元素化合物知识及化学用语来解答。
(1)铝热反应应用于铁轨的焊接,由①可知C为Al、G为Fe2O3、B为Fe、H为Al2O3,反应的化学方程式为2Al+Fe2O3![]() 2Fe+Al2O3。CO2是最常见的温室气体,由②可知E为Mg、I为CO2、F为MgO、D为C。综上可知A为O2。
2Fe+Al2O3。CO2是最常见的温室气体,由②可知E为Mg、I为CO2、F为MgO、D为C。综上可知A为O2。
(2)Fe2O3与盐酸反应的离子方程式为Fe2O3+6H+=2Fe3++3H2O,FeCl3与铜粉完全反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+,可知n(Cu)=n(Fe2O3)=![]() ="0.01" mol,需铜粉的质量为0.01 mol×64 g/mol=0.64g。
="0.01" mol,需铜粉的质量为0.01 mol×64 g/mol=0.64g。
(3)Al与过量NaOH溶液反应的离子方程式为:2Al+2OH-+2H2O=![]() +
+
3H2↑,反应后溶液为NaAlO2,与过量CO2反应的离子方程式为:![]() 。
。
(4)Mg在CO2中燃烧的化学方程式为:2Mg+CO2![]() 2MgO+C,观察到的现象是镁条剧烈燃烧,生成白色粉末,反应器内壁附着黑色固体。
2MgO+C,观察到的现象是镁条剧烈燃烧,生成白色粉末,反应器内壁附着黑色固体。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】标准状况下,等体积的NH3和CH4两种气体,下列有关说法错误的是
A.所含分子数目相同B.所含氢原子物质的量之比为3∶4
C.质量之比为16∶17D.密度之比为17∶16
查看答案和解析>>
科目:高中化学 来源: 题型:
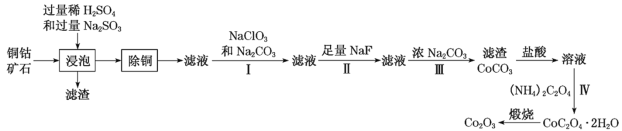
【题目】某铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,及一定量的Fe2O3、MgO和CaO等。由该矿石制Co2O3的部分工艺流程如图:
回答下列问题:
(1)“浸泡”过程中,钴(III)可转化为CoSO4,写出该转化的相关化学方程式:__。
(2)“除铜”若选用MnS,计算常温下该“除铜”反应的平衡常数K=__。[保留2位有效数字;已知常温下Ksp(MnS)=2.5×10–13,Ksp(CuS)=1.3×10–36]
(3)①步骤I中加入NaClO3与Fe2+反应的离子方程式为__。
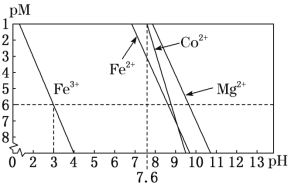
②常温下,溶液中金属离子(Mn+)的pM[pM=–lgc(Mn+)]随溶液pH变化关系如图所示,设加入NaClO3后,溶液中的c(Co2+)为0.1molL-1,依据如图分析,步骤I中加入Na2CO3调整溶液pH范围为__。[当c(Mn+)≤10–6molL–1,即认为该金属离子沉淀完全]
(4)步骤II中加入足量NaF的目的是__。
(5)过滤出的CoC2O42H2O固体经洗涤后,证明固体已洗净的操作为__。
(6)若某工厂用m1kg该铜钴矿石制备了m2kgCo2O3,假设产率为a,则该矿石中钴元素的百分含量为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g)![]() 2NH3(g)ΔH<0,下列研究目的和示意图相符的是
2NH3(g)ΔH<0,下列研究目的和示意图相符的是
A | B | C | D | |
研究目的 | 压强对反应的影响P2>P1 | 温度对反应的影响 | 平衡体系增加氮气对反应的影响 | 催化剂对反应的影响 |
图示 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】干燥管A中为块状白色固体,B中为淡黄色粉末,C中为白色固体。并将A、B、C按如图所示装置连接,当打开活塞(Ⅰ)(Ⅱ)时,D中蜡烛火焰明亮;打开活塞(Ⅰ)(Ⅲ)时,D中蜡烛火焰熄灭;关闭活塞(Ⅰ)时,A中反应自行停止。
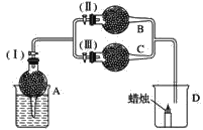
试根据上述实验事实,回答以下各问题:
(1)A中发生的化学反应是______________。
(2)在装置B中的淡黄色粉末是______________。
(3)在干燥管C中的白色固体应为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如下:
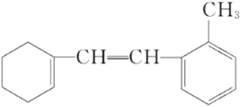
(1)该物质苯环上一氯代物有____________________种;
(2)1 mol该物质和溴水混合,消耗Br2的物质的量为____________________mol;
(3)1 mol该物质和H2加成最多需H2____________________mol;
(4)下列说法不正确的是____________________。
A.此物质可发生加成、取代、氧化等反应 |
B.该物质易溶于水 |
C.该物质能使溴水褪色 |
D.该物质能使酸性KMnO4溶液褪色 |
E.分子式是C15H18
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.300℃时,将2mol A和2mol B两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g) ΔH=Q,2min末达到平衡,生成0.8mol D。
2C(g)+2D(g) ΔH=Q,2min末达到平衡,生成0.8mol D。
(1)300℃时,该反应的平衡常数表达式为K=___已知K300℃<K350℃,则ΔH___0(填“>”或“<”)。
(2)在2min末时,B的平衡浓度为____,D的平均反应速率为___。
(3)若温度不变,缩小容器容积,则A的转化率____(填“增大”“减小”或“不变”)。
II.A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同。
(已知:2NO2![]() N2O4 ΔH<0)
N2O4 ΔH<0)
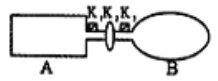
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是v(A)___(填“>”、“<”、“=”)v(B);若打开活塞K2,气球B将___(填“增大”、“减小”、“不变”)。
(2)室温下,若A、B都保持体积不变,将A套上—个绝热层,B与外界可以进行热传递,则达到平衡时,___中的颜色较深。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】成熟的苹果中含有淀粉、葡萄糖和无机盐等,某课外兴趣小组设计了一组实验证明某些成份的存在,请你参与并协助他们完成相关实验。
(1)用小试管取少量的苹果汁,加入_________,溶液变蓝,则苹果中含有淀粉。
(2)用小试管取少量的苹果汁,加入新制Cu(OH)2悬浊液,并加热,产生砖红色的沉淀,则苹果中含有____________(写分子式)。
(3)葡萄糖在一定条件下可以得到化学式为C2H6O的化合物A。
A + CH3COOH→有香味的产物
① 含A的体积分数为75%的水溶液可以用做_____________。
②写出化合物A与CH3COOH反应的化学方程式为______________________,该反应的类型为_____。
(4)苹果中含有苹果酸,测得其相对分子质量为134。取0.02mol苹果酸,使其完全燃烧,将燃烧后的产物先后通过足量的无水CaCl2和碱石灰,两者分别增重1.08g 和 3.52g。则分子中C、H原子的个数比_______。苹果酸的分子式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应速率和化学反应限度的说法中正确的是( )
A.化学反应速率是衡量化学反应进行快慢程度的物理量
B.化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示
C.当一个可逆反应达到平衡状态时,这就是这个反应所能达到的限度,即使条件改变,该限度都不改变
D.平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com