
| 4 |
| 3 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 1.2mol |
| 2mol |
| 4 |
| 3 |
| 4 |
| 2 |
| 3 |
| 2 |
| 4 |
| 3 |
| 1 |
| 2 |
| 2 |
| 3 |
| 2 |
| 3 |
| 4 |
| 3 |
| 4 |
| 3 |


科目:高中化学 来源: 题型:
| A、苯酚钠溶液中通入少量CO2 2C6H5ONa+CO2+H2O→2C6H5OH+Na2CO3 | ||
B、乙酸乙酯在酸性条件下水解 CH3COOCH2CH3+H218O
| ||
C、溴乙烷的消去反应 C2H5Br+NaOH
| ||
D、乙醛和银氨溶液反应 CH3CHO+2Ag(NH3)2OH
|
查看答案和解析>>
科目:高中化学 来源: 题型:
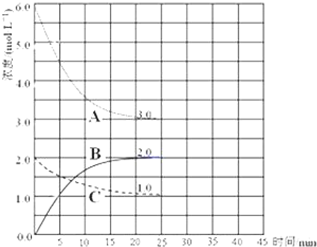 目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ/mol;
目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ/mol;查看答案和解析>>
科目:高中化学 来源: 题型:
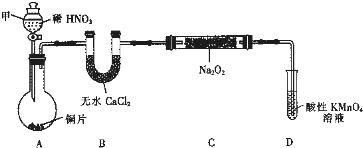
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg?L-1 | 0 | 20 | 40 | 60 | 80 |
| 粉碎浸泡 |
| 过滤 |
| 明矾 |
| 静置过滤 |
| 稀释至1L |
| 实验方案 | 实验现象 | 实验结论 |
| 维生素C可以降低泡菜中NaNO2的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
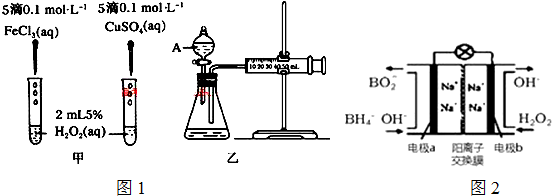
查看答案和解析>>
科目:高中化学 来源: 题型:
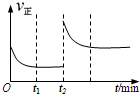 一定温度下,在一个10L密闭容器中只投反应物发生某可逆反应,其平衡常数表达式为K=
一定温度下,在一个10L密闭容器中只投反应物发生某可逆反应,其平衡常数表达式为K=| c(CO)?c(H2) |
| c(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
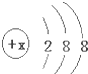 有几种元素的微粒的最外电子层结构如图所示,其中:
有几种元素的微粒的最外电子层结构如图所示,其中:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com