
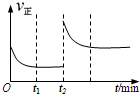
 一定温度下,在一个10L密闭容器中只投反应物发生某可逆反应,其平衡常数表达式为K=
一定温度下,在一个10L密闭容器中只投反应物发生某可逆反应,其平衡常数表达式为K=| c(CO)?c(H2) |
| c(H2O) |


科目:高中化学 来源: 题型:
| A、汽油、苯、乙醇都属于烃类物质 |
| B、含5个碳原子的有机物,分子中最多可形成5个碳碳单键 |
| C、等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等 |
| D、二氧化硫和乙烯都能使溴水褪色,二者反应原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 4 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
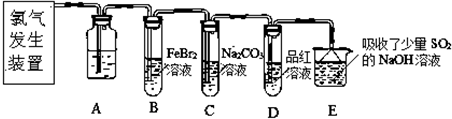
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在浓硫酸、加热条件下,乙醇和乙酸反应 |
| B、乙醇使酸性高锰酸钾褪色 |
| C、在铁粉存在的条件下,苯与液溴反应 |
| D、甲烷与氯气在光照条件下反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com