


科目:高中化学 来源: 题型:
| A、168g | B、42g |
| C、126g | D、60g |
查看答案和解析>>
科目:高中化学 来源: 题型:
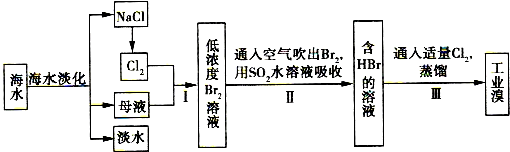
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
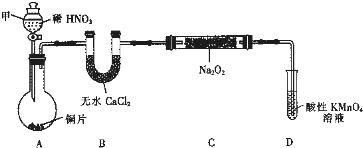
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg?L-1 | 0 | 20 | 40 | 60 | 80 |
| 粉碎浸泡 |
| 过滤 |
| 明矾 |
| 静置过滤 |
| 稀释至1L |
| 实验方案 | 实验现象 | 实验结论 |
| 维生素C可以降低泡菜中NaNO2的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
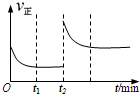 一定温度下,在一个10L密闭容器中只投反应物发生某可逆反应,其平衡常数表达式为K=
一定温度下,在一个10L密闭容器中只投反应物发生某可逆反应,其平衡常数表达式为K=| c(CO)?c(H2) |
| c(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(SO2) |
| c(SO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该合金中铜与镁的物质的量之比是2:1 |
| B、该浓硝酸中HNO3的物质的量浓度是14.0 mol?L-1 |
| C、NO2和N2O4 的混合气体中,NO2和N2O4 的物质的量之比是1:4 |
| D、得到2.54 g沉淀时,加入NaOH溶液的体积是640 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com