
如图所示,将铁棒和石墨棒插入1 L 1 mol·L-1食盐水中。下列说法正确的是( )
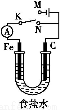
A.若电键K与N连接,铁被保护不会腐蚀
B.若电键K与N连接,正极反应式是:4OH--4e-=2H2O+O2↑
C.若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜
D.若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成了1 mol NaOH
科目:高中化学 来源:2014高考化学二轮专题突破 专题九化学反应速率化学平衡练习卷(解析版) 题型:填空题
工业上合成氨的反应:N2(g)+3H2(g)  2NH3(g)ΔH=-92.60 kJ·mol-1。
2NH3(g)ΔH=-92.60 kJ·mol-1。
(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g)  2NH3(g),下列说法能说明上述反应向正反应方向进行的是________(填序号)。
2NH3(g),下列说法能说明上述反应向正反应方向进行的是________(填序号)。
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N—H键的同时生成2n mol H—H键
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
④混合气体的平均摩尔质量增大
⑤容器内的气体密度不变
(2)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
NH3 | 0 | 0.20 |
| 1.00 | 1.00 |
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题一物质的组成性质和分类练习卷(解析版) 题型:选择题
下列有关物质的性质与应用相对应的是( )
A.NH3极易溶于水,可用作制冷剂
B.Al2O3熔点高,可用作耐高温材料
C.SO2具有氧化性,可用于漂白品红、织物等
D.BaCO3能与盐酸反应,可用于治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题9金属及其化合物练习卷(解析版) 题型:选择题
下列说法中正确的是( )
A.在Cu(NO3)2和AgNO3的混合溶液中加入一定量的Fe粉,充分反应后,所得的固体可能仅为Cu和Fe的混合物
B.隔绝空气,把Na2O2投入FeCl2溶液中,既有无色气体生成,最终又有白色沉淀生成
C.金属钠投入到FeCl3溶液,有黑色铁粉生成
D.NaHCO3溶液与Fe2(SO4)3溶液混合,既有无色气体生成,最终又有红褐色沉淀生成
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题8电化学原理练习卷(解析版) 题型:填空题
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
阳离子 | Na+、K+、Cu2+ |
阴离子 | S |
如图1所示装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示。请回答下列问题:

(1) M为直流电源的 极,b电极上发生的电极反应为 。
(2)计算e电极上生成的气体在标准状况下的体积为 。
(3)写出乙烧杯中的总反应的离子方程式: 。
(4)要使丙烧杯中的C溶液恢复到原来的状态,需要进行的操作是(写出要加入的物质和质量) 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题7电解质溶液练习卷(解析版) 题型:填空题
已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液 (填“显酸性”、“显碱性”、“显中性”或“酸碱性无法确定”)。
(2)某温度下,若向0.1 mol/L的NaHA溶液中滴入0.1 mol/L KOH溶液使混合溶液中c(H+)=c(OH-),则此时该混合溶液中,下列关系一定正确的是 (填字母)。
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s) Ca2+(aq)+A2-(aq) ΔH>0
Ca2+(aq)+A2-(aq) ΔH>0
①温度升高时,Ksp (填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+) 。
(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题7电解质溶液练习卷(解析版) 题型:选择题
有常温下物质的量浓度均为0.1 mol/L的①氨水②NH4Cl溶液③Na2CO3溶液 ④NaHCO3溶液,下列说法正确的是( )
A.4种溶液pH的大小顺序:①>④>③>②
B.等体积的①和②溶液混合后若pH>7:c(Cl-)>c(N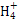 )
)
C.溶液①、③由水电离产生的c(OH-):①<③
D.溶液③、④等体积混合后,溶液中c(C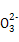 )>c(HC
)>c(HC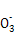 )
)
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题5物质结构 元素周期律练习卷(解析版) 题型:填空题
有关元素X、Y、Z、W的信息如下:
元素 | 有关信息 |
X | 原子半径为0.074 nm,其氢化物的结构模型可表示为: |
Y | 原子半径为0.102 nm,其原子核外电子排布为: |
Z | 人体中必需微量元素中含量最多,体内缺失会引起贫血 |
W | 所在主族序数与所在周期序数之差为4 |
请回答下列问题:
(1)W在元素周期表中的位置是 。
(2)Y与W相比,非金属性较强的是 (填元素符号),下列事实能证明这一结论的是 (填字母)。
a.W元素氢化物的稳定性大于Y元素氢化物的稳定性
b.W元素氢化物水溶液的酸性强于Y元素氢化物水溶液的酸性
c.W元素的单质能与Y元素的氢化物反应,置换出Y单质
d.W的最高价含氧酸比Y的最高价含氧酸的酸性强
(3)Z元素和X元素可形成离子Z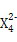 ,含该离子的盐是优良的绿色消毒剂和无机絮凝剂。
,含该离子的盐是优良的绿色消毒剂和无机絮凝剂。
①Z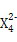 具有强氧化性,能杀菌消毒,还原产物是Z3+。
具有强氧化性,能杀菌消毒,还原产物是Z3+。
②含该离子的盐用作絮凝剂的原因是(用离子方程式和简要的文字说明) 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题2化学常用计量 溶液练习卷(解析版) 题型:选择题
下列说法正确的是
A.2.24 L CO2中共有的原子数为0.3×6.02×1023
B.1.8 g N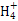 共有的质子数为6.02×1023
共有的质子数为6.02×1023
C.1 mol重水分子所含中子数为10×6.02×1023
D.7.8 g Na2O2中含有的阴离子数为0.2×6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com