
【题目】有A、B、C、D四种元素,已知A元素原子的第一层和第三层电子数相同;B元素原子的第二层比第一层电子数多5个;C元素的+3价阳离子和氖原子具有相同的电子数;D元素的原子核外有4个电子层, 第一层与第二层电子数之和等于第三层与第四层电子数之和。写出:
(1)元素符号:A ,B ,C ,D 。
(2)A、D的原子结构示意图 、 ,C的离子结构示意图
化合物AB2的电子式____________ 化学键类型为__________
【答案】(1)Mg;F;Al;Ca;(2)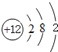 ,
,![]() ,
,![]() (3)
(3)![]() ,离子键
,离子键
【解析】试题分析:(1)A、B、C、D四种元素,A元素原子的第一层和第三层电子数相同,第三层电子数为2,故A为Mg;B元素原子的第二层比第一层电子数多5个,第二层电子数为7,故B为F元素;C元素的+3价阳离子和氖原子具有相同的电子数,则C为Al;D元素的原子核外有4个电子层,第一层与第二层电子数之和等于第三层与第四层电子数之和,则第三层、第四层电子数之和为10,说明原子核外各层电子数分别为2、8、8、2,故D为Ca元素,故答案为:Mg;F;Al;Ca;
(2)A为Mg,原子结构示意图为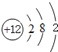 ,D为Ca,原子结构示意图为
,D为Ca,原子结构示意图为![]() ,C的离子为Al3+,离子结构示意图为
,C的离子为Al3+,离子结构示意图为![]() ;
;
(3)A与B所形成的化合物为MgF2,电子式为![]() ,含有离子键。
,含有离子键。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】I、某研究性学习小组为了验证CH4是否具有还原性,设计了如下实验:

(1)实验过程中观察到无水CuSO4逐渐变蓝,澄清石灰水出现浑浊现象,则CH4与CuO反应的化学方程式为____ __ 。
(2)研究小组将CH4通入溴水时,发现溴水逐渐褪色,你认为原因可能是____ 。
请设计一个实验方案证明你的结论(用文字表示,不必画实验装置图)___ _____________ 。
II、(1)工业上用电石-乙炔生产氯乙烯的反应如下:CaO+3C![]() CaC2+CO
CaC2+CO
CaC2+2H2O![]() CH≡CH+Ca(OH)2 CH≡CH+HCl
CH≡CH+Ca(OH)2 CH≡CH+HCl ![]() CH2=CHCl
CH2=CHCl
电石-乙炔法的优点是流程简单,产品纯度高,而且不依赖与石油资源。
电石-乙炔法的缺点是: 、 。
(2)乙烷和氯气反应可制得ClCH2CH2Cl,ClCH2CH2Cl加热分解得到氯乙烯和氯化氢。请设计以乙烯和氯气为原料制取氯乙烯的方案(其他原料自选),用化学方程式表示(不必注明反应条件)。要求:①反应产生的氯化氢必须用于氯乙烯的制备;②不再产生其他废液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取SO2的反应原理为:Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:

(1)这些装置的连接顺序(按气体左右的方向)是 → → → →
→ → → (填各接口的编号)。
(2)实验时甲仪器橡胶支管的作用与原理是 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。
(4)Ⅳ处观察到的现象是 。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会 (填“增大”“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25摄氏度时,现有浓度均为0.10 mol/L的四种溶液:①氨水 ② NaOH溶液 ③CH3COOH溶液 ④盐酸。请回答:
(1)①溶液中c(H+) c(OH-) (填“>”、“<”或“=”)。
(2)醋酸的电离方程式是 。
(3)①对水的电离平衡产生的影响是 ,理由是 。
(4)溶液②和溶液③等体积混合后所得溶液显碱性,原因是 (用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期中简单离子半径最小的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子。则:
(1)X的分子式为
(2)E的简单阴离子的原子结构简图
(3)F在元素周期表中的位置是 (填周期和族)
(4)B、C、E分别与A形成的化合物中最稳定的是 (写化学式);
(5)A与C形成的化合物中含非极性键的化合物的电子式为_____________.
(6)D的最高价氧化物的水化物与E的最高价氧化物的水化物反应的化学反应方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的外围电子排布式______,它位于周期表______区。
(2)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如图甲,分子中碳原子轨道的杂化类型为_______;1 mol C60分子中σ键的数目为_____个。

(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓(GaAs)、硫化镉(CdS)薄膜电池等。
①第一电离能:As____Ga(填“>”、“<”或“=”)。
②SeO2分子的空间构型为________。
(4)三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在太阳能电池制造中得到广泛应用。它可在铜的催化作用下由F2和过量的NH3反应得到,该反应的化学方程式为3F2+4 NH3 Cu NF3+3 NH4F,该反应中NH3的沸点 (填“>”、“<”或“=”)HF的沸点,NH4F固体属于 晶体。往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________ _______ 。图乙为一个金属铜的晶胞,此晶胞立方体的边长为a pm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则阿伏加德罗常数可表示为________ mol-1(用含a、ρ的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香烃A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为_____________;
(2)A与溴的四氯化碳溶液反应的化学方程式为_____________,反应类型是_____________;
(3)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式_____________;
(4)在一定条件下,由A聚合得到的高分子化合物的结构简式为_____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题:

(1)以下叙述中,正确的是__________。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
(2)变化过程中能量转化的形式主要是:甲为__________;乙为__________。
(3)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式:
_____________________________________________________________
②(4分)氢氧燃料电池,是一种高效无污染的清洁电池它分碱性(用KOH做电解质)和酸性(用硫酸做电解质)氢氧燃料电池,
(1)如果是碱性燃料电池则负极反应方程式是: .
(2)如果是酸性燃料电池则负极反应方程式是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的每一个方格表示有关的一种反应物或生成物,其中X为正盐,A、C、D均为无色气体。

(1)写出有关的物质化学式。X: C: E: F:
(2)写出反应①的化学方程式_____________________________________
(3)写出反应②的离子方程式_____________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com