
【题目】25摄氏度时,现有浓度均为0.10 mol/L的四种溶液:①氨水 ② NaOH溶液 ③CH3COOH溶液 ④盐酸。请回答:
(1)①溶液中c(H+) c(OH-) (填“>”、“<”或“=”)。
(2)醋酸的电离方程式是 。
(3)①对水的电离平衡产生的影响是 ,理由是 。
(4)溶液②和溶液③等体积混合后所得溶液显碱性,原因是 (用离子方程式表示)。
【答案】(1)<;(2)CH3COOH![]() CH3COO-+H+;(3)抑制水的电离,NH3·H2O
CH3COO-+H+;(3)抑制水的电离,NH3·H2O![]() NH4++OH-, H2O
NH4++OH-, H2O![]() H++OH-,氨水电离出的OH-浓度增加使得水的电离平衡向左移动;(4)两溶液等体积混合得到CH3COONa 溶液,CH3COO-+H2O
H++OH-,氨水电离出的OH-浓度增加使得水的电离平衡向左移动;(4)两溶液等体积混合得到CH3COONa 溶液,CH3COO-+H2O![]() CH3COOH+OH-。
CH3COOH+OH-。
【解析】
试题分析:(1)①氨水溶液显碱性,则溶液中c(H+)<c(OH-) 。
(2)醋酸是弱电解质,则醋酸的电离方程式是CH3COOH![]() CH3COO-+H+。
CH3COO-+H+。
(3)①一水合氨是弱碱:NH3·H2O![]() NH4++OH-,H2O
NH4++OH-,H2O![]() H++OH-,氨水电离出的OH-浓度增加使得水的电离平衡向左移动,抑制水的电离。
H++OH-,氨水电离出的OH-浓度增加使得水的电离平衡向左移动,抑制水的电离。
(4)溶液②和溶液③等体积混合后所得溶液是醋酸钠溶液,醋酸根水解,溶液显碱性,水解方程式为CH3COO-+H2O![]() CH3COOH+OH-。
CH3COOH+OH-。


科目:高中化学 来源: 题型:
【题目】1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )。
A. 该合金中铜与镁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C. NO2和N2O4的混合气体中,NO2的体积分数是80%
D. 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药、陶瓷釉药等。钡盐行业生产中排出大量的钡泥[主要含有BaCO3、BaSO3、Ba(FeO2)2等],某主要生产BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),其部分工艺流程如下:
又已知:①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7;
②Ba(NO3)2晶体的分解温度:592℃;
③KSP(BaSO4)=1.1×10-10,KSP(BaCO3)=5.1×10-9。

(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。试用离子方程式说明提纯原理:
。
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,反应的化学方程式为: 。
(3)该厂结合本厂实际,选用的X为 (填序号);
A.BaCl2 B.BaCO3 C.Ba(NO3)2 D.Ba(OH)2
(4)中和I使溶液的p H为4~5目的是 ;结合离子方程式简述原理 。
(5)从Ba(NO3)2溶液中获得其晶体的操作方法是 。
(6)测定所得Ba(NO3)2晶体的纯度:准确称取W克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m克,则该晶体的纯度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中不考虑两球的浮力变化)

A.杠杆为导体或绝缘体时,均为B端高A端低
B.杠杆为导体或绝缘体时,均为B端低A端高
C.当杠杆为导体时,B端低A端高;杠杆为绝缘体时,B端高A端低
D.当杠杆为导体时,B端高A端低;杠杆为绝缘体时,B端低A端高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下图装置进行实验,并回答下列问题

(1)判断装置的名称:A池为 B池为 。
(2)铜极为______极,电极反应式为 。
(3)B装置中,C1与C2均为石墨棒,石墨棒C1为___极,电极反应式为 ,石墨棒C2附近发生的实验现象为 。
(4)当C2极析出224mL(标准状态)气体时,锌的质量减少 g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修2:化学生活与技术]以黄铁矿为原料,采用接触法生产硫酸的流程可简示如下:

请回答下列问题:
(1)在炉气制造中,生成SO2的化学方程式为_________________________________________;
(2)炉气精制的作用是将含SO2的炉气________、________及干燥,如果炉气不经过精制,对SO2催化氧化的影响是___________________________________________;
(3)精制炉气(含SO2体积分数为7%、O2为11%、N2为82%)中SO2平衡转化率与温度及压强关系如下图所示。在实际生产中,SO2催化氧化反应的条件选择常压、450 ℃左右(对应图中A点),而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是____________。

(4)在SO2催化氧化设备中设置热交换器的目的是________,从而充分利用能源。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,已知A元素原子的第一层和第三层电子数相同;B元素原子的第二层比第一层电子数多5个;C元素的+3价阳离子和氖原子具有相同的电子数;D元素的原子核外有4个电子层, 第一层与第二层电子数之和等于第三层与第四层电子数之和。写出:
(1)元素符号:A ,B ,C ,D 。
(2)A、D的原子结构示意图 、 ,C的离子结构示意图
化合物AB2的电子式____________ 化学键类型为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、白藜芦醇的结构简式如下图。它广泛存在于食物(如桑椹、花生,尤其是葡萄)中,可能具有抗癌性。下列有关白藜芦醇的说法正确的是
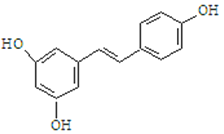
A.该有机物属于醇类
B.1mol该有机物与H2加成时最多消耗1mol H2
C.1mol该有机物与Br2反应时最多消耗6mol Br2
D.1mol该有机物最多消耗3mol NaOH
Ⅱ、根据下列的有机物合成路线回答问题:

(1)写出A、B的结构简式:A 、B 。
(2)写出各步反应类型:
① 、② 、③ 。
(3)写出②、③的反应方程式:
②
③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A→F有如下转化关系:

已知:①
②核磁共振氢谱显示C的分子中含有4种不同化学环境的氢原子,且峰面积之比为3:2:2:1。
③F是酯类化合物,分子中苯环上的一溴代物只有两种。
(1)A的分子式是 ,主要用途是 (写一种)。
(2)检验B中官能团的常用方法是 。
(3)D物质的名称为 。
(4)C+E→F的化学方程式是 。
(5)X与E互为同分异构体,且X有下列性质,符合条件的X有 种。
①接触NaHCO3有二氧化碳气体产生。
②与银氨溶液共热有银镜现象。
③1摩尔X与足量钠反应有1摩尔气体产生。
(6)Y与E也互为同分异构体,属于酯类化合物,分子中只含一种官能团,且苯环上的一硝基取代物只有一种,则Y的结构简式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com