
【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2 L的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法正确的是( )
A. 当容器中气体的密度不变时,该反应达到平衡状态
B. 该反应进行到第3分钟时,逆反应速率小于正反应速率
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01 mol/(L·min)
D. 容器内达到平衡状态时的压强与起始时的压强之比为5∶4
【答案】B
【解析】
A.未达到平衡状态,气体的密度也一直不变;
B.该反应进行到第3分钟时向正反应方向进行;
C.根据v=△c/△t计算;
D.根据压强之比等于物质的量之比计算。
A.容器内气体密度不再发生变化,容器容积不变,气体的总质量不变,所以气体的密度始终不变,因此密度不能作为判断平衡状态的依据,故A错误;
B.根据表中数据可知反应进行到第3分钟时没有达到平衡状态,反应向正反应方向进行,则逆反应速率小于正反应速率,故B正确;
C.由表格数据可知,4min时达到平衡,消耗二氧化硫为0.20mol-0.08mol=0.12mol,即生成SO3为0.12mol,浓度是0.06mol/L,则用SO3表示的平均反应速率为0.06mol/L÷4min=0.015 mol/(Lmin),故C错误;
D.开始SO2和O2的物质的量分别为0.2mol、0.1mol,由表格数据可知平衡时SO2、O2、SO3的物质的量分别为0.08mol、0.04mol、0.12mol,由压强之比等于物质的量之比可知,达到平衡状态时的压强与起始时的压强之比为(0.08+0.04+0.12)/(0.2+0.1)=4:5,故D错误;
答案选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.氯化钠溶液在电流的作用下电离成钠离子和氯离子
B.Cl2的水溶液能导电,但Cl2是非电解质
C.盐酸能导电,故盐酸是电解质
D.硫酸钡难溶于水,但硫酸钡是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 在8NH3 + 3Cl2 = N2+ 6NH4Cl反应中,被氧化的原子与被还原的原子的物质的量之比为
A.8:3 B.1:3 C.3:8 D.3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A. In是第五周期第ⅢA族元素
B. 11549In的中子数与电子数的差值为17
C. 原子半径:In>Al
D. 碱性:In(OH)3>RbOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )
2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )
A. v(A)=0.15 mol·L-1·min-1B. v(B)=0.01 mol·L-1·s-1
C. v(C)=0.40 mol·L-1·min-1D. v(D)=0.45 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被称为“国防金属”的镁 ,60%来自海洋,从海水中提取镁的正确方法是( )

A. 海水![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
B. 海水![]() MgCl2溶液―→MgCl2(熔融)
MgCl2溶液―→MgCl2(熔融)![]() Mg
Mg
C. 海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
D. 海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液―→MgCl2(熔融)
MgCl2溶液―→MgCl2(熔融)![]() Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A~H的转化关系如下图所示。其中A是植物生长调节剂,它的产量可以用来衡量一个国家的石油化工发展水平;D是一种合成高分子材料,此类物质如果大量使用易造成“白色污染”;G能与NaHCO3溶液反应放出CO2气体。
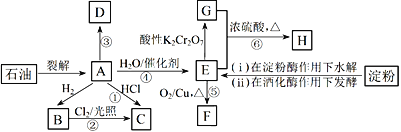
请回答下列问题:
(1)E的官能团名称为____________。反应③的反应类型__________________________。
(2)关于有机物A、B、C、D的下列说法,正确的是___________________(选填序号)。
a.B不能使溴水或酸性高锰酸钾溶液褪色,但A和D可以
b.B的同系物中,当碳原子数≥5时开始出现同分异构现象
c.等质量的A和D完全燃烧时消耗O2的量相等,生成CO2的量也相等
(3)写出下列反应的化学方程式:
反应④:_________________________________。
反应⑤:_____________________________________。
(4)C是一种速效局部冷冻麻醉剂,可由反应①或②制备,请指出用哪一个反应制备较好:________,并说明理由:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且![]() 的值与温度高低有关。当n(KOH)=a mol,下列有关说法错误的是
的值与温度高低有关。当n(KOH)=a mol,下列有关说法错误的是
A.若某温度下,反应后![]() =11,则溶液中
=11,则溶液中![]() =
=![]()
B.参加反应的氯气的物质的量等于![]() a mol
a mol
C.改变温度,反应中转移电子的物质的量ne的范围:![]() a mol = ne =
a mol = ne = ![]() a mol
a mol
D.改变温度,产物中KClO3的最大理论产量为![]() a mol
a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化物法生产亚氯酸钠的工艺流程图:
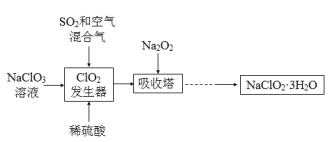
已知:
①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释至10%以下较安全;
(1)NaClO2中Cl的化合价为______。
(2)在发生器中鼓入SO2和空气混合气的原因是______ (填序号)。
A 空气稀释ClO2以防止爆炸
B SO2将NaClO3氧化成ClO2
C 稀硫酸可以增强NaClO3的氧化性
(3)Na2O2可改为H2O2和NaOH的混合溶液,吸收塔中发生的反应的化学方程式______;吸收塔的温度不能超过20oC,主要原因是______。
(4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是______ (填序号)。
A 蒸馏 B 蒸发浓缩 C 灼烧 D 过滤 E 冷却结晶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com