
【题目】下列说法正确的是
A.氯化钠溶液在电流的作用下电离成钠离子和氯离子
B.Cl2的水溶液能导电,但Cl2是非电解质
C.盐酸能导电,故盐酸是电解质
D.硫酸钡难溶于水,但硫酸钡是电解质
科目:高中化学 来源: 题型:
【题目】某校学生用如下图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。

请回答下列问题:
(1)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。装置Ⅱ中生成有机物的反应为__________________________________________(填化学方程式),装置Ⅲ中小试管内苯的作用是__________________________________。
(2)能说明苯与液溴发生了取代反应的现象是_____________________。
(3)反应结束后,要让装置Ⅰ中的水倒吸入装置Ⅱ中,这样操作的目的是___________。简述这一操作的方法__________。
(4)将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。
①用蒸馏水洗涤、振荡、分液;②用5%的NaOH溶液洗涤、振荡、分液;③用蒸馏水洗涤、振荡、分液;④加入无水CaCl2粉末干燥;⑤_______________(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为纪念 Dmitri Mendeleev 发明的元素周期表诞生 150 周年,联合国将 2019 年定为“国际化学元素周期表年”。 a、 b、 c、 d、四种短周期元素分别位于三个周期,其原子的最外层电子数和原子半径之间的关系如图所示。下列说法中错误的是

A. a为氢元素
B. 原子半径 c<d
C. b的最高价氧化物对应的水化物为强酸
D. a与 c组成的一种化合物中既含极性键又含非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10 (g) + 1/2O2 (g)= C4H8 (g)+H2O(g) ΔH2=119 kJ·mol1
③H2(g) + 1/2O2(g)= H2O(g) ΔH3=242kJ·mol1
反应①的ΔH1为________kJ·mol1。
(2)检验硫酸铁溶液中是否存在Fe2+的方法是_______________________________。
(3)对于可逆反应C(s) + H2O(g) ![]() CO(g) + H2(g), ΔH>0,达到平衡后,改变条件对平衡有何影响,回答下列问题:
CO(g) + H2(g), ΔH>0,达到平衡后,改变条件对平衡有何影响,回答下列问题:
①升高温度,平衡__________移动(填“正反应方向”“逆反应方向”或“不”,下同)。
②加入固体碳,平衡________移动。
③加入水蒸气,平衡_________移动。
④扩大容器体积,平衡_________移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2,排尽装置内的空气。
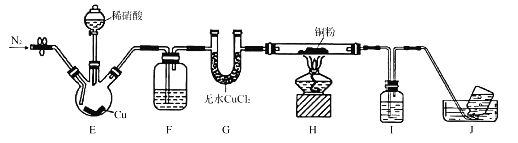
已知:在溶液中.FeSO4+NO![]() [Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法不正确的是
[Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法不正确的是
A. 装置B、E中的试剂依次为水、硫酸亚铁溶液
B. 若观察到装置D中红色粉末变黑色,则NO与Cu发生了反应
C. 实验结束后,先关闭分液漏斗的活塞,再熄灭酒精灯
D. 装置F收集的气体中可能含有NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-铜空气燃料电池是通过一种复杂的铜腐蚀“现象”产生电力,其放电过程为2Li+Cu2O+H2O===2Cu+2Li++2OH—,下列说法不正确的是

A. 放电时,每转移2 mol电子,负极减轻14 g
B. 将有机电解质换成Li2SO4水溶液,也能使该电池正常工作
C. 放电时,正极的电极反应式为Cu2O+H2O+2e—===2Cu+2OH—
D. 放电时,锂电极表面发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产、生活中广泛存在。
(1)键能是将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知下列化学键的键能如下表:

写出1mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
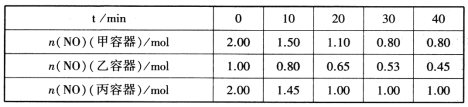
①该反应为________(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率v(NO)=____________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
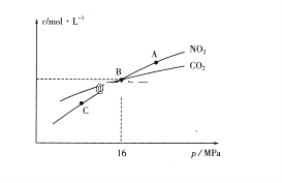
①A、C两点的浓度平衡常数关系:Kc(A)________Kc(C)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是________(填“A”或“B”或“C”)点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是石蜡油在炽热碎瓷片的作用下产生乙烯,并检验乙烯性质的实验。
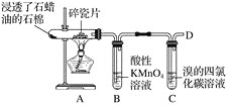
回答下列问题:
(1)从装置A中出来的气体中含有烷烃和________。
(2)B中酸性高锰酸钾溶液________,这是因为生成的气体被________(填“氧化”或“还原”),反应类型为________。
(3)C中溴的四氯化碳溶液________,发生反应的化学方程式:____________,反应类型为________。
(4)在D处点燃之前必须进行的操作是__________,燃烧时反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2 L的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法正确的是( )
A. 当容器中气体的密度不变时,该反应达到平衡状态
B. 该反应进行到第3分钟时,逆反应速率小于正反应速率
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01 mol/(L·min)
D. 容器内达到平衡状态时的压强与起始时的压强之比为5∶4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com