
【题目】为纪念 Dmitri Mendeleev 发明的元素周期表诞生 150 周年,联合国将 2019 年定为“国际化学元素周期表年”。 a、 b、 c、 d、四种短周期元素分别位于三个周期,其原子的最外层电子数和原子半径之间的关系如图所示。下列说法中错误的是

A. a为氢元素
B. 原子半径 c<d
C. b的最高价氧化物对应的水化物为强酸
D. a与 c组成的一种化合物中既含极性键又含非极性键
【答案】C
【解析】
题中已经说明四种短周期元素分别为三个周期。同一周期中,从左到右,随着原子序数的增大,原子最外层的电子数也要增大,原子半径在逐渐减小。a的化合价为1,且原子半径是最小的,则a一定是H;d的原子半径比c大,最外层电子数比c多,则c一定在第二周期,d在第三周期;c、d的最外层电子数分别为4和6,则c为C,d为S;b的原子半径最大,最外层电子数为1,则b为Na。综上所述,a为H,b为Na,c为C,d为S。
A. a为H,b为Na,c为C,d为S ,A正确;
B. 如图所示,c的原子半径小于d,B正确;
C. b的最高价氧化物对应的水化物是NaOH,是强碱,C错误;
D. a、c组成的化合物中,除了甲烷之外,都具有C-C键和C-H键,即含极性键和非极性键,D正确;
故合理选项为C。


科目:高中化学 来源: 题型:
【题目】实验室中需要配制2 mol/L的NaCl溶液950 mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
A. 950 mL,111.2 g B. 500 mL,117 g
C. 1 000 mL,117 g D. 1 000 mL,111.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下图所示:
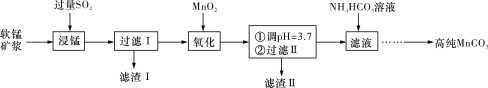
(1)“过滤Ⅰ”所得“滤渣Ⅰ”的主要成分为_________(填化学式)。
(2)“氧化”过程中除了发生MnO2与SO2的反应外,还发生另一氧化还原反应,写出该反应的离子方程式______________________________________________________________。
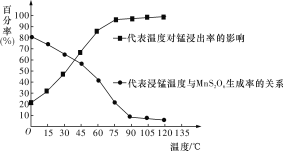
(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是____________________________________。
(4)向“过滤Ⅱ”所得的滤液中加入NH4HCO3溶液时温度控制在30~35 ℃,温度不宜太高的原因是_________________________________________________________________。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有CO2气体生成,写出反应的离子方程式:_____________________________________________________________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验沉淀是否洗涤干净的方法是___________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭。生产中使用它作橡胶的低温硫化剂和黏结剂。向熔融的硫中通入限量氯气即可生成S2Cl2,进一步氯化可得SCl2。S2Cl2、SCl2的某些性质如下表所示:
水溶性 | 密度(g/cm3) | 熔点 | 沸点 | |
S2Cl2 | 空气中发烟雾,遇水即水解 | 1.687 | -76 ℃ | 138 ℃ |
SCl2 | 溶于水且剧烈反应 | 1.621 | -122 ℃ | 59 ℃ |
实验室可用如图所示装置制备少量S2Cl2。请回答下列问题:
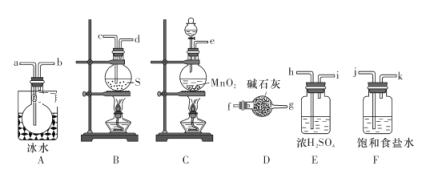
(1)已知S2Cl2分子中各原子最外层均满足8电子稳定结构,则S2Cl2的电子式为__________。
(2)从上图所示装置中选用某一装置制取Cl2,发生反应的离子方程式为__________。
(3)欲得到较纯净的S2Cl2,上述仪器装置的连接顺序为:
e→______→_____→______→______→______→______→a→b→______→_______(按气流方向填小写字母代号)。
(4)仪器D的名称是__________,D中碱石灰的作用是__________。
(5)为了获得更纯净的S2Cl2,需要对产品进行的操作是_______。
(6)若将S2Cl2放入水中同时产生沉淀和气体,写出反应的化学方程式:__________;该反应中被氧化和被还原的元素的质量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2A(g)+B(g)![]() 2C(g)
2C(g)
(1)在一个体积为2L的密闭容器中充入6 mol A和3mol B进行上述反应,保持温度不变,2min后达到平衡,测得混合气体中B的体积分数为25%,用A浓度变化表示的化学反应速率为___________,求该温度下平衡常数K=______________;
(2)下图表示在密闭容器中上述反应达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a~b过程中改变的条件可能是________;b~c过程中改变的条件可能是________;请将增大压强时,反应速度变化情况画在c~d处。____________
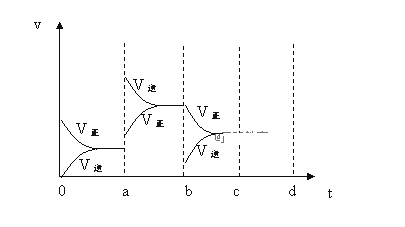
(3)以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡后,容器内温度将______(填“升高”、“降低”或“不变”(假设容器不与外界进行热交换))。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.氯化钠溶液在电流的作用下电离成钠离子和氯离子
B.Cl2的水溶液能导电,但Cl2是非电解质
C.盐酸能导电,故盐酸是电解质
D.硫酸钡难溶于水,但硫酸钡是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 在8NH3 + 3Cl2 = N2+ 6NH4Cl反应中,被氧化的原子与被还原的原子的物质的量之比为
A.8:3 B.1:3 C.3:8 D.3:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com