
| A. | x个 | B. | $\frac{x}{4}$个 | C. | $\frac{2x}{3}$个 | D. | $\frac{x}{2}$个 |
科目:高中化学 来源: 题型:选择题
| A. | 3:2:1 | B. | 1:2:3 | C. | 1:3:2 | D. | 3:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HF>HCl>H2S | B. | 原子半径:Br>Se>Cl | ||
| C. | 还原性:S2->Se2->Cl- | D. | 酸性:HBrO4>HClO4>H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 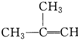 -CH3+Br2→ -CH3+Br2→ | |
| B. | CH2=CH-CH3+HCl→ | |
| C. | CH2=CH-CH=CH2+Br2→ | |
| D. | CH3-CH=CH2+H2O$→_{加热、加压}^{催化剂}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 漂白粉的主要成分为次氯酸钙 | |
| B. | 实验室可用浓硫酸干燥氨气 | |
| C. | 实验室可用NaOH溶液处理NO2和HCl废气 | |
| D. | 从海水可获得在常温下为液体的单质是Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com