
| A. | 原电池反应一定是自发进行的氧化还原反应,且△H<0 | |
| B. | △H<0,△S<0的反应肯定能自发进行 | |
| C. | 体系能量增大和混乱度增大都有促使反应自发进行的倾向 | |
| D. | CaCO3(s)=CaO(s)+CO2(g)的△H>0,△S<0,该反应在较高温度下能自发进行 |
分析 A.依据原电池构成的条件判断;
B.依据△G=△H-T△S<0判断;
C.依据判据△G=△H-T△S<0结合焓变熵变分析判断;
D.依据△G=△H-T△S是否小于0判断.
解答 解:A.能构成原电池的反应必须是自发进行的放热的氧化还原反应,故A正确;
B.△H<0,△S<0,则△H-T△S是否小于0取决于T,故B错误;
C.根据△H-T△S可知,当△H<0,△S>0时△H-T△S一定小于0,反应一定能自发进行,也就是说体系能量减小和混乱度增大都有利于反应自发进行,故C错误;
D.△H>0,△S<0,在任何温度下△H-T△S都大于0,反应不能自发进行,故D错误;
故选A.
点评 本题考查了反应自发进行的判断方法,题目难度不大,明确△H-T△S判据的使用方法为解答关键,注意掌握反应热与焓变的关系,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:多选题
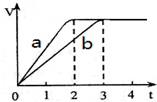 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图所示,下列说法正确的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图所示,下列说法正确的是( )| A. | 曲线a代表Al的反应过程,曲线b代表Mg的反应过程 | |
| B. | Mg和Al的质量之比为3:2 | |
| C. | Mg和Al的物质的量之比为3:2 | |
| D. | Mg和Al的反应速率之比为3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制的氯水在光照条件下颜色变浅 | |
| B. | 加入催化剂有利于氨的氧化反应 | |
| C. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| D. | 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C、O、S | B. | N、Na、Mg | C. | C、F、P | D. | N、O、P |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com