
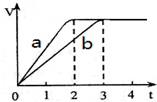
 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图所示,下列说法正确的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图所示,下列说法正确的是( )| A. | 曲线a代表Al的反应过程,曲线b代表Mg的反应过程 | |
| B. | Mg和Al的质量之比为3:2 | |
| C. | Mg和Al的物质的量之比为3:2 | |
| D. | Mg和Al的反应速率之比为3:2 |
分析 A.Mg活泼性大于Al,则反应速率加快的为Mg;
B.再根据m=nM计算质量之比;
C.根据生成氢气的量相等及电子守恒计算出Mg和Al的物质的量之比;
D.Mg与盐酸反应速率更快,生成氢气的量相同,则反应速率与时间成反比.
解答 解:硫酸过量,Mg、Al完全反应,由图可知生成氢气体积相同,则氢气物质的量相等,假设氢气为1mol,根据电子转移守恒,Mg的物质的量为$\frac{1mol×2}{2}$=1mol、Al物质的量为$\frac{1mol×2}{3}$=$\frac{2}{3}$mol,
A.金属性Mg>Al,故Mg与盐酸反应速率更快,则曲线a代表Mg的反应过程,曲线b代表Al的反应过程,故A错误;
B.Mg、Al的质量之比为1mol×24g/mol:$\frac{2}{3}$mol×27g/mol=4:3,故B错误;
C.Mg、Al的物质的量之比为1mol:$\frac{2}{3}$mol=3:2,故C正确;
D.金属性Mg>Al,故Mg与盐酸反应速率更快,根据图象可知镁粉和铝粉反应完所需时间之比为2:3,生成氢气的量相同,则反应速率与时间成正比,则Mg和Al的反应速率之比为3:2,故D正确;
故选CD.
点评 本题以化学反应图象形式,考查化学方程式有关计算、化学反应速率等,关键是明确金属完全反应且生成氢气的体积相等,注意利用守恒法与赋值法解答.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{22.4}$mol/L | B. | $\frac{1}{44.8}$mol/L | C. | $\frac{1}{33.6}$mol/L | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体中分散质粒子的直径大小在1~100nm之间 | |
| B. | 可以利用过滤的方法分离胶体和溶液 | |
| C. | 可以利用丁达尔效应区分胶体和溶液 | |
| D. | 胶体在一定条件下能稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 俄国化学家门捷列夫是通过实验的方法建立元素周期表的 | |
| B. | 现在我们课本上所列的元素周期表是由门捷列夫在1869年制定的 | |
| C. | 通常在元素周期表的右上方寻找制取催化剂的元素 | |
| D. | 元素的性质随着原子序数的递增而呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热蒸干NaCl、MgCl2溶液时可以得到晶体NaCl、MgCl2 | |
| B. | 相同条件下,等物质的量浓度的溶液导电能力:HCl>NH3•H2O | |
| C. | 溶液中离子结合质子(氢离子)的能力:C2O42->HC2O4->SO42- | |
| D. | 海洋封存CO2会导致局部海洋水体酸性增强,会破坏海洋生态环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池反应一定是自发进行的氧化还原反应,且△H<0 | |
| B. | △H<0,△S<0的反应肯定能自发进行 | |
| C. | 体系能量增大和混乱度增大都有促使反应自发进行的倾向 | |
| D. | CaCO3(s)=CaO(s)+CO2(g)的△H>0,△S<0,该反应在较高温度下能自发进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com