
【题目】下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。
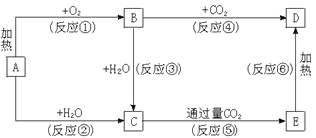
请填写下列空白:
(1)C的电子式______________,B的电子式______________,D的化学式_______________。
(2)以上反应中属于氧化还原反应的有____________________(填写编号)。
(3)写出B→D的化学方程式___________________。
【答案】(1)![]() ;
;![]() ;Na2CO3
;Na2CO3
(2)①②③④ (3)2Na2O2+2CO2=2Na2CO3+O2↑
【解析】
试题分析:它们的焰色反应都是黄色,且A为单质,则A为Na,反应①是加热,因此B为Na2O2,D为Na2CO3,C为NaOH,E:NaHCO3;
(1)根据以上分析可知C是氢氧化钠,含有离子键和共价键的离子化合物,电子式为![]() ;B是过氧化钠,含有离子键和共价键的离子化合物,电子式为
;B是过氧化钠,含有离子键和共价键的离子化合物,电子式为![]() ;碳酸钠的化学式为Na2CO3;
;碳酸钠的化学式为Na2CO3;
(2)判断是否是氧化还原反应,看是否有化合价的升降,有化合价的改变则为氧化还原反应,属于氧化还原反应的①②③④,不属于氧化还原反应的是⑤⑥;
(3)反应④是过氧化钠和CO2反应,方程式为2Na2O2+2CO2=2Na2CO3+O2↑。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验测得,某有机物A相对分子质量为72。
(1)若A是烃,其分子式为______,它有_____种同分异构体,沸点最高的是__________________ (写结构简式)。若该烃与Cl2发生取代反应,生成的一氯代物只有1种,则该A的结构简式为______。
(2)若该有机物3.6g完全燃烧生成0.15molCO2和0.1molH2O,则A的分子式为_______。若它是一种不饱和羧酸,该酸与甲醇发生酯化反应的化学方程式为(注明反应条件):__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是
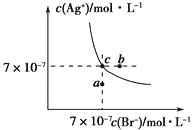
A. 在t℃时,AgBr的Ksp为4.9×10-13
B. 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C. 图中a点对应的是AgBr的不饱和溶液
D. 在t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K≈816
AgBr(s)+Cl-(aq)平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.煤的干馏是化学变化
B.煤液化后可以得到甲醇等液体燃料
C.煤中含有苯和甲苯,可以用蒸馏的方法把它们分离出来
D.从萃取分液后溴的四氯化碳溶液中提取溴可以用蒸馏的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2-+2e-=E,B-2e-=B2+则A、B、D、E金属性由强到弱的顺序为( )
A.A﹥B﹥E﹥D B.D﹥A﹥B﹥E C.D﹥E﹥A﹥B D.A﹥B﹥D﹥E
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用元素符号或化学用语回答下列问题:
族 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)下列事实能证明②的非金属性比⑦强的是 。
A.Na2CO3+SiO2![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
B.SiO2+2C![]() Si+2CO↑
Si+2CO↑
C.Na2SiO3+CO2+2H2O = H2SiO3↓+Na2CO3
D.CH4比SiH4稳定
(2)①、④、⑤三种元素组成化合物所含化学键类型有_________________。
(3)④、⑤、⑥所形成的简单离子半径由大到小的顺序:______。(用元素符号表示)
(4)①、②、⑧三种元素按原子个数之比为11︰5︰1组成的有机化合物中含有两个-CH3的同分异构体有 种。
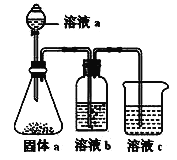
(5)某同学设计实验证明②、③、⑦的非金属性强弱关系。
①溶液a和b分别为_______________,_______________。
②溶液c中的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制的流程。
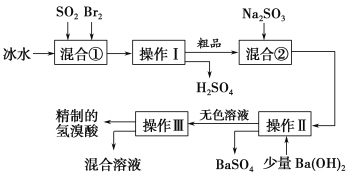
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为________________________________。
(2)混合①中使用冰水的目的是________________________________。
(3)操作Ⅱ和操作Ⅲ的名称分别是________、________。
(4)混合液②中加入Na2SO3的目的是_________________________________。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)常带有淡淡的黄色。于是甲、乙两同学设计了简单实验加以探究:甲同学假设工业氢溴酸呈淡黄色是因为含有Fe3+,则用于证明该假设所用的试剂为________,若假设成立可观察的现象为___________。乙同学假设工业氢溴酸呈淡黄色是因为________________________,其用于证明该假设所用的试剂为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、某研究性学习小组为了验证CH4是否具有还原性,设计了如下实验:
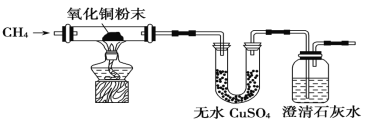
(1)实验过程中观察到无水CuSO4逐渐变蓝,澄清石灰水出现浑浊现象,则CH4与CuO反应的化学方程式为____ __ 。
(2)研究小组将CH4通入溴水时,发现溴水逐渐褪色,你认为原因可能是____ 。
请设计一个实验方案证明你的结论(用文字表示,不必画实验装置图)___ ________ _____ 。
II、(1)工业上用电石-乙炔生产氯乙烯的反应如下:CaO+3C![]() CaC2+CO
CaC2+CO
CaC2+2H2O![]() CH≡CH+Ca(OH)2 CH≡CH+HCl
CH≡CH+Ca(OH)2 CH≡CH+HCl ![]() CH2=CHCl
CH2=CHCl
电石-乙炔法的优点是流程简单,产品纯度高,而且不依赖与石油资源。
电石-乙炔法的缺点是: 、 。
(2)已知ClCH2CH2Cl加热分解得到氯乙烯和氯化氢。请设计以乙烯和氯气为原料制取氯乙烯的方案(其他原料自选),用化学方程式表示(不必注明反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对于杂质(括号中的物质为杂质)的检验和除杂方法均正确的是
选项 | 目标物质和杂质 | 检验方法 | 除杂方法 |
A | FeCl2(FeCl3) | 滴入KSCN | 通入过量氯气 |
B | NaCl(NH4Cl) | 加热 | 加热 |
C | KNO3(NaCl) | 焰色反应(透过蓝色钴玻璃) | 重结晶 |
D | Cl2(HCl) | 通入AgNO3溶液 | 通入饱和NaCl溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com