
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用元素符号或化学用语回答下列问题:
族 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)下列事实能证明②的非金属性比⑦强的是 。
A.Na2CO3+SiO2![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
B.SiO2+2C![]() Si+2CO↑
Si+2CO↑
C.Na2SiO3+CO2+2H2O = H2SiO3↓+Na2CO3
D.CH4比SiH4稳定
(2)①、④、⑤三种元素组成化合物所含化学键类型有_________________。
(3)④、⑤、⑥所形成的简单离子半径由大到小的顺序:______。(用元素符号表示)
(4)①、②、⑧三种元素按原子个数之比为11︰5︰1组成的有机化合物中含有两个-CH3的同分异构体有 种。
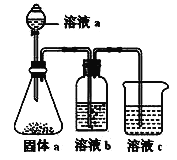
(5)某同学设计实验证明②、③、⑦的非金属性强弱关系。
①溶液a和b分别为_______________,_______________。
②溶液c中的离子方程式为______________________。
【答案】(1)C D (2分)(错选多选不给分);(2)离子键、(极性)共价键;(2分)
(3) O2—>Na+>Al3+(2分); (4) 4;(2分)
(5)①硝酸(HNO3)(2分) 饱和NaHCO3溶液 (2分)
② SiO32-+CO2+H2O=H2SiO3↓+CO32-(2分)
【解析】试题分析:根据元素在周期表中的位置可知①~⑧分别是H、C、N、O、Na、Al、Si、Cl。
(1)A.反应Na2CO3+SiO2![]() Na2SiO3+CO2↑ 利用的是难挥发性物质制备易挥发性物质,不能说明非金属性强弱,A错误;B.反应SiO2+2C
Na2SiO3+CO2↑ 利用的是难挥发性物质制备易挥发性物质,不能说明非金属性强弱,A错误;B.反应SiO2+2C![]() Si+2CO↑利用的是难挥发性物质制备易挥发性物质,不能说明非金属性强弱,B错误;C.较强酸能制备较弱酸,非金属性越强,最高价含氧酸的酸性越强,则根据反应Na2SiO3+CO2+2H2O=H2SiO3↓+Na2CO3可以是说明碳元素的非金属性强于硅,C正确;D.非金属性越强,氢化物越稳定,则CH4比SiH4稳定可以说明碳元素的非金属性强于硅,D正确,答案选CD。
Si+2CO↑利用的是难挥发性物质制备易挥发性物质,不能说明非金属性强弱,B错误;C.较强酸能制备较弱酸,非金属性越强,最高价含氧酸的酸性越强,则根据反应Na2SiO3+CO2+2H2O=H2SiO3↓+Na2CO3可以是说明碳元素的非金属性强于硅,C正确;D.非金属性越强,氢化物越稳定,则CH4比SiH4稳定可以说明碳元素的非金属性强于硅,D正确,答案选CD。
(2)①、④、⑤三种元素组成化合物是氢氧化钠,所含化学键类型有离子键、(极性)共价键;
(3)④、⑤、⑥所形成的简单离子具有相同的核外电子排布,其离子半径随原子序数的增大而减小,则离子半径由大到小的顺序为O2—>Na+>Al3+;
(4)①、②、⑧三种元素按原子个数之比为11︰5︰1组成的有机化合物分子式为C5H11Cl,其中含有两个-CH3的同分异构体有CH3CH2CH2CHClCH3,CH3CH2CHClCH2CH3,CH3CH2CH(CH3)CH2Cl,(CH3)2CHCH2CH2Cl,共计4种。
(5)由装置图可知,实验原理是利用较强酸制备较弱酸,硝酸易挥发,为防止干扰应除去,故锥形瓶中产生二氧化碳,应为硝酸与碳酸盐反应,溶液b吸收挥发的硝酸,应为饱和的碳酸氢钠,烧杯中应是二氧化碳与硅酸钠反应生成硅酸,则
①由上述分析可知,溶液a为硝酸,溶液b为饱和NaHCO3溶液;
②溶液c中的离子方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-。


科目:高中化学 来源: 题型:
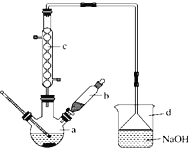
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图如图所示,物质的有关数据信息如下表,请按下列合成步骤回答问题:
苯 | 溴 | 溴苯 | |
密度/gcm3 | 0.88 | 3.10 | 1.50 |
沸点/C | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液态溴。 向a中滴入几滴溴,有白色烟雾产生,是因为生成了______气体。继续滴加至液溴滴完。装置d的作用是_________;
(2) 液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤,NaOH 溶液洗涤的作用是___________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_____________________;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中必须的是______;(填入正确选项前的字母)
A.重结晶 B. 过滤 C. 蒸馏 D. 萃取
(4)在该实验中,a的容积最适合的是______.(填入正确选项前的字母)
A. 25mL B. 50mL C. 250mL D. 500mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是
A.“西气东输”中的“气”主要成分是甲烷
B.乙烯的结构简式为CH2CH2
C.分子式为C6H6的物质一定是苯
D.乙烯使溴水退色说明乙烯与溴发生了取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修2:化学与技术】利用天然气合成氨的工艺流程示意如下,完成下列填空:
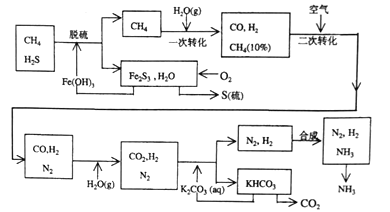
(1)天然气脱硫采用了Fe(OH)3,Fe(OH)3可以再生循环,可以再生循环.写出上述工艺中由Fe2S3再生Fe(OH)3的化学方程式是 。含硫化合物遇到Fe3+的反应情况与反应条件有关.以NaHS溶液与FeCl3溶液混合为例:将溶液置于80°C的热水浴中,发现有红褐色沉淀生成,写出该反应的化学方程式: 。解释该反应在温度升高后能发生,而低温时不易发生的原因 。
(2)n mol CH4经一次转化后产生CO 0.9n mol,产生H2___mol(用含n的代数式表示)
(3)K2CO3和CO2又反应在加压下进行.加压的理论依据是 (多选扣分)
a.相似相溶原理
b.勒夏特列原理
c.艘喊中和原理
(4)整个流程有兰处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,还有一处循环未标明.请指出上述流程图中第三处循环的物质是 ·
(5)工业上制取的硝酸铵的流程图如下.请回答下列问题:
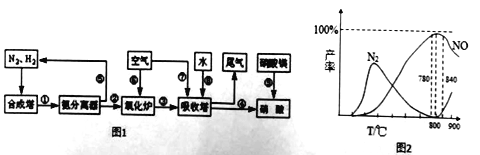
据图2可知工业上氨催化氧生成NO时.应该控制温度在 左右.其中在吸收塔中为了尽可能提高硝酸的产率,减少尾气排放.常常调节空气与NO的比例.写出吸收塔内发生反应的总化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。
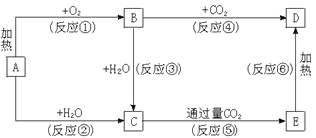
请填写下列空白:
(1)C的电子式______________,B的电子式______________,D的化学式_______________。
(2)以上反应中属于氧化还原反应的有____________________(填写编号)。
(3)写出B→D的化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)完全燃烧0.1 mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9 g,浓碱液增重17.6 g。该烃的化学式为______,并写出其所有可能的结构简式:__________________。
(2)某烷烃的相对分子质量为128,该烷烃的化学式为__________________。
(3)在120 ℃和101 kPa的条件下,某气态烃和一定质量的氧气混合,点燃完全反应后再恢复到原来的温度时,气体体积不变,则该烃分子内的氢原子个数______。
A.小于4 B.大于4
C.等于4 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛,请回答下列问题:
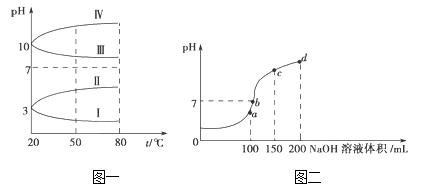
(1)相同条件下,pH相同的NH4Al(SO4)2中c(NH4+)_________(填“=”、“>” 或“<”)NH4HSO4中c(NH4+)。
(2)如图1是0.1 molL﹣1电解质溶液的pH随温度变化的图象。
①其中符合0.1 molL﹣1 NH4Al(SO4)2的pH随温度变化的曲线是_______(填写字母);
②室温时,0.1 molL﹣1 NH4Al(SO4)2中2c(SO42-)﹣c(NH4+)﹣3c(Al3+)=________ molL﹣1(填数值)
(3)室温时,向100 mL 0.1molL﹣1 NH4HSO4溶液中滴加0.1molL﹣1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。
试分析图中a、b、c、d四个点,水的电离程度最大的是_____;在c点,溶液中各离子浓度由大到小的排列顺序是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z是原子序数依次增大的同一周期主族元素,W、X是金属,Y、Z是非金属元素。请回答下列问题:
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为______。
(2)W与Y可形成化合物W2Y,该化合物的电子式为______________。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为______________。
(4)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是___>____>____>____。
(5)Z的最高价氧化物为无色液体,该物质与水可发生反应。写出该反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能成功的是( )
A. 将乙酸和乙醇混合加热制乙酸乙酯
B. 苯和浓溴水反应制溴苯
C. 向浓苯酚中加几滴稀溴水观察沉淀
D. 用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热煮沸观察红色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com