
����Ŀ��������Ԫ��W��X��Y��Z��ԭ���������������ͬһ��������Ԫ�أ�W��X�ǽ�����Y��Z�Ƿǽ���Ԫ�ء���ش��������⣺
��1��W��X���Ե�����������Ӧ��ˮ������Է�Ӧ�����κ�ˮ���÷�Ӧ�����ӷ���ʽΪ______��
��2��W��Y���γɻ�����W2Y���û�����ĵ���ʽΪ______________��
��3��Y�ĵͼ�������ͨ��Z���ʵ�ˮ��Һ�У�������Ӧ�Ļ�ѧ����ʽΪ______________��
��4��W��X��Y��Z����Ԫ�ؼ����ӵ����Ӱ뾶�ɴ�С��˳����___>____>____>____��
��5��Z�����������Ϊ��ɫҺ�壬��������ˮ�ɷ�����Ӧ��д���÷�Ӧ�Ļ�ѧ����ʽ��_______��
���𰸡���1��OH����Al(OH)3��AlO2����2H2O ��2��![]()
��3��SO2��Cl2��2H2O��H2SO4��2HCl ��4��S2��Cl��Na��Al3�� ��5��Cl2O7��H2O��2HClO4
�����������������W��X��Y��Z��ԭ���������������ͬһ��������Ԫ�أ�W��X�ǽ�����Y��Z�Ƿǽ���Ԫ�أ���
��1��W��X���Ե�����������Ӧ��ˮ������Է�Ӧ�����κ�ˮ����W��Na��X��Al����Ӧ�����ӷ���ʽΪOH����Al(OH)3��AlO2����2H2O ��
��2��W��Y���γɻ�����W2Y����Y��S�������Ǻ������Ӽ������ӻ�����ĵ���ʽΪ![]() ��
��
��3��Y��S����Z��Cl��Y�ĵͼ��������������ͨ��Z���ʵ�ˮ��Һ�У�����������������Ϊ���ᣬ������Ӧ�Ļ�ѧ����ʽΪSO2��Cl2��2H2O��H2SO4��2HCl��
��4�����ӵĺ�����Ӳ���Խ�࣬���Ӱ뾶Խ���ں�������Ų���ͬʱ�����Ӱ뾶��ԭ���������������С�����W��X��Y��Z����Ԫ�ؼ����ӵ����Ӱ뾶�ɴ�С��˳����S2����Cl����Na����Al3����
��5��Z�����������Ϊ��ɫҺ�壬��������ˮ�ɷ�����Ӧ���ɸ����ᣬ�÷�Ӧ�Ļ�ѧ����ʽΪCl2O7��H2O��2HClO4��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��2����ѧ�뼼�����������ǹ�ҵ�ϻ���þ�Ͻ���ϵij��÷�����������Ϊ��
![]()
��1������Ԥ����
�����飺�и�̬��е���鷨��ʪ���е���鷨�������������Σ�յķ����� �������� ��
�������ۺ���������ۺ�����һ���Գ�ȥ�����˵ķ����� ��
a�����ȼ�ϴ�ӣ�����
b�����л��ܼ��ܽ⣬����
c������������ȥ
��2��þ�Ͻ��ڼ��ȵ�935Kʱ�ۻ���������������ͨ������������������ö�����̼����������������ɵĺ���� ���û�ѧ����ʽ��ʾ����
��3������þ�е��������ɼ��������ɰ��B2O3����ȥ������FeB2�������仯ѧ��Ӧ����ʽΪ ��
��4��þ�Ͻ���˺�����֮�⣬������������������C2Cl6���Գ�ȥҺ̬þ�е����������ܰ���ת��ΪAl4 C3������
C2Cl6=2C+3Cl2 3C+4Al=Al4C3
����������¯�ų�����Ⱦ�������� ��
�����1tþ�Ͻ��У���ռ3.6�������ȥ��������Ҫ����C2Cl6 g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ���һ���֣������Ԫ���������ڱ��е�λ�ã���Ԫ�ط��Ż�ѧ����ش��������⣺
�� | IA | 0 | ||||||
1 | �� | ��A | ��A | ��A | ��A | ��A | ��A | |
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | ||||
��1��������ʵ��֤�����ķǽ����Ա���ǿ���� ��
A��Na2CO3+SiO2![]() Na2SiO3+CO2��
Na2SiO3+CO2��
B��SiO2+2C![]() Si+2CO��
Si+2CO��
C��Na2SiO3+CO2+2H2O �� H2SiO3��+Na2CO3
D��CH4��SiH4�ȶ�
��2����������������Ԫ����ɻ�����������ѧ��������_________________��
��3���������������γɵļ����Ӱ뾶�ɴ�С��˳��______������Ԫ�ط��ű�ʾ��
��4����������������Ԫ�ذ�ԭ�Ӹ���֮��Ϊ11�U5�U1��ɵ��л��������к�������-CH3��ͬ���칹���� �֡�
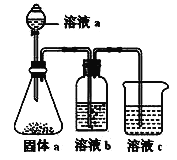
��5��ijͬѧ���ʵ��֤�������������ķǽ�����ǿ����ϵ��
����Һa��b�ֱ�Ϊ_______________��_______________��
����Һc�е����ӷ���ʽΪ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���δ�������ҽѧ���δȵġ�ϴԩ��¼�����С������鶾���ļ��أ��������鶾����ԭ���ǣ�4Ag��2H2S��O2===2X��2H2O������˵����ȷ����
A��X�Ļ�ѧʽΪAgS
B�������鶾ʱ������������ʧȥ����
C����Ӧ��Ag��H2S���ǻ�ԭ��
D��ÿ����1 mol X����Ӧת��2 mol e��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I��ij�о���ѧϰС��Ϊ����֤CH4�Ƿ���л�ԭ�ԣ����������ʵ�飺
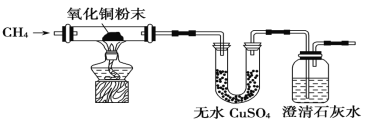
��1��ʵ������й۲쵽��ˮCuSO4����������ʯ��ˮ���ֻ���������CH4��CuO��Ӧ�Ļ�ѧ����ʽΪ____ __ ��
��2���о�С�齫CH4ͨ����ˮʱ��������ˮ����ɫ������Ϊԭ�������____ ��
�����һ��ʵ�鷽��֤����Ľ���(�����ֱ�ʾ�����ػ�ʵ��װ��ͼ)___ ________ _____ ��
II����1����ҵ���õ�ʯ-��Ȳ��������ϩ�ķ�Ӧ���£�CaO+3C![]() CaC2+CO
CaC2+CO
CaC2+2H2O![]() CH��CH+Ca(OH)2 CH��CH+HCl
CH��CH+Ca(OH)2 CH��CH+HCl ![]() CH2=CHCl
CH2=CHCl
��ʯ-��Ȳ�����ŵ������̼���Ʒ���ȸߣ����Ҳ�������ʯ����Դ��
��ʯ-��Ȳ����ȱ���ǣ� �� ��
��2����֪ClCH2CH2Cl���ȷֽ�õ�����ϩ���Ȼ��⡣���������ϩ������Ϊԭ����ȡ����ϩ�ķ���������ԭ����ѡ�����û�ѧ����ʽ��ʾ������ע����Ӧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��д��ȷ����
A.�����軯����Һ����Fe3+��Fe3++3SCN��![]() Fe��SCN��3��
Fe��SCN��3��
B.���ҽ���Һ�м���ϡ���ᡢ˫��ˮ��2I��+2H++H2O2![]() I2+2H2O
I2+2H2O
C.ĥ�ڲ����Լ�ƿ���ռ���Һ��ʴ��SiO2+2Na++2OH��![]() Na2SiO3��+H2O
Na2SiO3��+H2O
D.NaHCO3��Һ������Ba��OH��2��Һ��ϣ�+OH��+Ba2+![]() H2O+BaCO3��
H2O+BaCO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaCl��NaClO�����������¿ɷ�����Ӧ:ClO-+ Cl-+2H+![]() Cl2��+H2O,ijѧϰС�����о�����Һ����Ҫ�ɷ�ΪNaCl��NaClO���ı��������
Cl2��+H2O,ijѧϰС�����о�����Һ����Ҫ�ɷ�ΪNaCl��NaClO���ı��������
��1��������Һ��NaClO�����տ����е�CO2����NaHCO3��HClO�����ʡ�д����ѧ��Ӧ����ʽ: ��
��2��ȡ��������Һ�����Թ���,��������һ��Ũ�ȵ�����,������ų���ͨ������װ�ü�������ijɷ�,�Ӷ��жϸ�����Һ�Ƿ���ʡ�
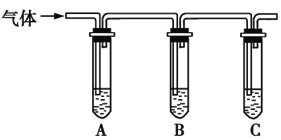
��ѡ�Լ�:98%Ũ���ᡢ1%Ʒ����Һ��1.0 mol��L-1KI-������Һ��1.0 mol��L-1NaOH��Һ������ʯ��ˮ������NaCl��Һ��
���������ʵ�鷽����
�����Լ� | Ԥ������ͽ��� |
���Թ�A�м�������; | ��A����Һ����ɫ,B����Һ����ɫ,C����Һ�����,������Һ���ֱ���; |
��3���õζ����ⶨ����Һ��NaClO��Ũ�ȡ�ʵ�鲽������:
����ȡ 25.00 mL����Һ������ƿ��,���������a mol��L-1Na2SO3��Һb mL��
���ζ���������c mol��L-1������KMnO4��Һװ�� ��������ʽ��������ʽ�����ζ����еζ�,ʹKMnO4��ʣ���Na2SO3������Ӧ������Һ����ɫ���dz��ɫ,�Ұ�����ں�ɫ���ֲ���ȥʱ,ֹͣ�ζ�,��¼���ݡ��ظ��ζ�ʵ��3��,���ƽ����������KMnO4��ҺV mL;�ζ��������漰�ķ�Ӧ��:NaClO+Na2SO3![]() NaCl+Na2SO4 ;2KMnO4+5Na2SO3+3H2SO4
NaCl+Na2SO4 ;2KMnO4+5Na2SO3+3H2SO4![]() K2SO4+2MnSO4+5Na2SO4+3H2O��
K2SO4+2MnSO4+5Na2SO4+3H2O��
�����㡣����Һ��NaClO��Ũ��Ϊ mol��L-1���ú�a��b��c��V�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���в���ȷ����
A.SO2ʹ��ˮ��ɫ����ϩʹKMnO4��Һ��ɫ��ԭ����ͬ
B��Ũ��ˮ�еμ�FeCl3������Һ���Ƶ�Fe��OH��3����
C���轺������װʳƷ�ĸ����
D�����������������뵼����������۵��Ӳ�ȴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Щ���Ļ���������˷ḻ�Ļ�ѧ֪ʶ�����н��Ͳ���ȷ���ǣ� ��
ѡ�� | ���Ļ����� | ��ѧ���� |
A | ������¯������ | ������� |
B | ������Ϳ��������ɫ��ͭ | �û���Ӧ |
C | ��ȼ��ݽ | ��ѧ��ת��Ϊ���� |
D | �����ׯ�� | ��Ȼ�̵� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com