
以下大小关系不正确的是
A. 熔点:Na>Mg B. 硬度:金刚石>晶体硅
C. 键能:H—F>H—Cl D. 晶格能:NaF>NaCl
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
醋酸是一种常见的弱酸。
(1)假如某醋酸溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10-3mol/L,则此时c(CH3COO-)约为
mol/L;计算此时醋酸的电离平衡常数,写出计算过程。
[注: c平衡(CH3COOH)≈0.10mol/L,水的电离可忽略不计]
(2)为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,准备了以下化学用品:0.20 mol·L-1与0.40 mol·L-1的HCl溶液、0.20 mol·L-1与0.40 mol·L-1的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298 K和308 K。
①酸液都取足量、相同体积,请你帮助完成以下实验设计表:
| 实验 编号 | 温度 (K) | 盐酸浓度 (mol·L-1) | 醋酸浓度 (mol·L-1) | 实验目的 |
| a | 298 | 0.20 | I.实验a和b是探究 对镁与盐酸反应速率的影响; II.实验a和c是探究 对镁与盐酸反应速率的影响; III.实验a和d是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别 | |
| b | 308 | 0.20 | ||
| c | 298 | 0.40 | ||
| d |
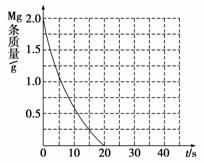 ②若①中实验a镁条消失的时间是20 s,则镁条剩余质量与时间关系图如下图。假设:该反应温度每升高10 ℃,反应速率是原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在此图中大致画出“实验b”、“实验d”的镁条剩余质量与时间关系曲线,请注意必要的标注。
②若①中实验a镁条消失的时间是20 s,则镁条剩余质量与时间关系图如下图。假设:该反应温度每升高10 ℃,反应速率是原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在此图中大致画出“实验b”、“实验d”的镁条剩余质量与时间关系曲线,请注意必要的标注。
(3)镁及其化合物在生产和生活中有着广泛的应用,依据镁的性质、用途等回答下列问题:
已知:①Mg(s)+2H2O(g)===Mg(OH)2(s)+H2(g) ΔH1=-441 kJ·mol-1
②H2O(g)===H2(g)+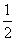 O2(g) ΔH2=+242 kJ·mol-1
O2(g) ΔH2=+242 kJ·mol-1
③Mg(s)+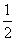 O2(g)===MgO(s) ΔH3=-602 kJ·mol-1。
O2(g)===MgO(s) ΔH3=-602 kJ·mol-1。
则氢氧化镁分解的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉的质量为
A.5.4g B.3.6g C.2.7g D.1.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,酸性由强到弱的排列顺序错误的是
A.HClO H2CO3 CH3COOH B.HClO4 HClO3 HClO2
C.HClO4 H2SO4 H3PO4 D.HClO4 HBrO4 HIO4
查看答案和解析>>
科目:高中化学 来源: 题型:
元素Cu的一种氯化物晶体的晶胞结构如图所示,计算推出该氯化物的化学式是______,它可与浓盐酸发生非氧化还原反应,生成配合物H2CuCl3,反应的化学方程式为____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
橙花醇具有玫瑰及苹果香气,可作为香料,其结构简式如下
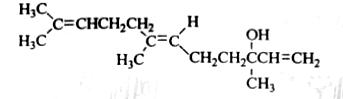
下列关于橙花醇的叙述,错误的是( )
既能发生取代反应,也能发生加成反应
在浓硫酸催化下加热脱水,可生成不止一种四烯烃(分子中含有四个碳碳双键的烯烃)
1mo1橙花醇在氧气中充分燃烧,需消耗470.4L氧气(标准状况)
1mo1橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗240g溴
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于σ键和π键的理解不正确的是( )
A.σ键能单独形成,而π键一定不能单独形成
B.σ键可以绕键轴旋转,π键一定不能绕键轴旋转
C.HCl 分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的
D.气体单质中一定存在σ键,可能存在π键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com