
醋酸是一种常见的弱酸。
(1)假如某醋酸溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10-3mol/L,则此时c(CH3COO-)约为
mol/L;计算此时醋酸的电离平衡常数,写出计算过程。
[注: c平衡(CH3COOH)≈0.10mol/L,水的电离可忽略不计]
(2)为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,准备了以下化学用品:0.20 mol·L-1与0.40 mol·L-1的HCl溶液、0.20 mol·L-1与0.40 mol·L-1的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298 K和308 K。
①酸液都取足量、相同体积,请你帮助完成以下实验设计表:
| 实验 编号 | 温度 (K) | 盐酸浓度 (mol·L-1) | 醋酸浓度 (mol·L-1) | 实验目的 |
| a | 298 | 0.20 | I.实验a和b是探究 对镁与盐酸反应速率的影响; II.实验a和c是探究 对镁与盐酸反应速率的影响; III.实验a和d是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别 | |
| b | 308 | 0.20 | ||
| c | 298 | 0.40 | ||
| d |
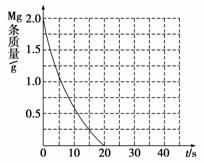 ②若①中实验a镁条消失的时间是20 s,则镁条剩余质量与时间关系图如下图。假设:该反应温度每升高10 ℃,反应速率是原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在此图中大致画出“实验b”、“实验d”的镁条剩余质量与时间关系曲线,请注意必要的标注。
②若①中实验a镁条消失的时间是20 s,则镁条剩余质量与时间关系图如下图。假设:该反应温度每升高10 ℃,反应速率是原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在此图中大致画出“实验b”、“实验d”的镁条剩余质量与时间关系曲线,请注意必要的标注。
(3)镁及其化合物在生产和生活中有着广泛的应用,依据镁的性质、用途等回答下列问题:
已知:①Mg(s)+2H2O(g)===Mg(OH)2(s)+H2(g) ΔH1=-441 kJ·mol-1
②H2O(g)===H2(g)+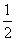 O2(g) ΔH2=+242 kJ·mol-1
O2(g) ΔH2=+242 kJ·mol-1
③Mg(s)+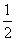 O2(g)===MgO(s) ΔH3=-602 kJ·mol-1。
O2(g)===MgO(s) ΔH3=-602 kJ·mol-1。
则氢氧化镁分解的热化学方程式是 。
科目:高中化学 来源: 题型:
Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的电子结构相同且Y的原子序数小于Z。
(1)Q的最高价氧化物,其固态属于_____________晶体,俗名叫 ;
(2)R的氢化物分子的空间构型是 ,属于 分子(填“极性”或“非极性”);它与X形成的化合物可作为一种重要的陶瓷材料,其化学式是 ;
(3)X的常见氢化物的空间构型是 ;它的另一氢化物X2H4是一种火箭燃料的成分,其电子式是 ;
(4)Q分别与Y、Z形成的共价化合物的化学式是_____________和_________________;Q和Y形成的分子的电子式是_____________,属于 分子(填“极性”或“非极性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
B.非金属元素呈现的最低化合价,其绝对值等于元素原子的最外层最子数
C.最外层有2个电子的原子都是金属原子
D.最外层有5个电子的原子都是非金属原子
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上也可以用CO2和H2反应制得甲醇。在2×105Pa、300℃的条件下,若有44g CO2与6g H2恰好完全反应生成气体甲醇和水,放出49.5kJ的热量。试写出该反应的热化学方程式: 。
某次实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
试回答下列问题:


(1)a点正反应速率 (填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是 ,最小的是 。
A.0~1min
B.1~3min
C.3~8min
D.8~11min
(3)计算该实验平衡时氢气的转化率和该条件下反应的平衡常数K(写出计算过程)。
(4)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线II对应的实验条件改变是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值。下列说法正确的是(用到的相对原子质量:H 1 O16 Al27)
A.18g 2H2O含有10NA个电子
B.1mol苯含有6NA个C-H键
C.常温常压下,22. 4L NH3约含有NA个NH3分子
D.27 g铝片投入足量浓H2SO4中生成1.5NA个SO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
在2A(g) + 3B(g)=C(g) + 4D(g)的反应中,下列表示该反应的化学反应速度最快的是
A.v (A)=0.5 mol/(L·s) B.v (B)=0.9 mol/(L·s)
C.v (C)=0.8 mol/(L·s) D.v (D)=1.0 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列过程或现象与水解无关的是
A.纯碱溶液去油污 B.配制氯化铁溶液时加入少量的盐酸
C.NaHCO3与Al2(SO4)3混合作泡沫灭火剂 D.铁在潮湿的环境下生锈
查看答案和解析>>
科目:高中化学 来源: 题型:
某硫原子的质量是a g,12C原子的质量是b g,若NA只表示阿伏加德罗常数的数值,则下列说法中正确的是
①该硫原子的相对原子质量为aNA
②m g该硫原子的物质的量为m/a mol
③该硫原子的摩尔质量是aNA g·mol-1
④a g该硫原子所含有的电子数为16
A.①②③ B.①②④ C.②③④ D.①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com