
工业上也可以用CO2和H2反应制得甲醇。在2×105Pa、300℃的条件下,若有44g CO2与6g H2恰好完全反应生成气体甲醇和水,放出49.5kJ的热量。试写出该反应的热化学方程式: 。
某次实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
试回答下列问题:


(1)a点正反应速率 (填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是 ,最小的是 。
A.0~1min
B.1~3min
C.3~8min
D.8~11min
(3)计算该实验平衡时氢气的转化率和该条件下反应的平衡常数K(写出计算过程)。
(4)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线II对应的实验条件改变是 。
【答案】CO2(g)+3H2(g) = CH3OH(g)+H2O(g) △H= -49.5kJ·mol-1
(3分,方程式2分,△H的表示1分,化学式、状态错误0分;-、焓变数值、单位错漏合扣1分;计量数用分数表示与焓变相匹配也给分)
(1)大于 (2分) (2)A(1分), D (1分)
(3)
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始物质的量浓度(mol /L) 3 4 0 0
转化物质的量浓度(mol /L) 1 3 1 1
平衡物质的量浓度(mol /L) 2 1 1 1 (1分)
H2的转化率=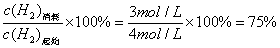 或0.75
或0.75
(2分,用分数表示扣1分, 代入数值不带单位不扣分,不考虑有效数字)
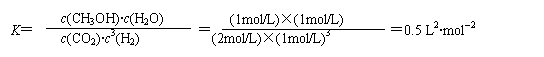
 (3分)
(3分)
(其中列式1分,代入数值1分,结果1分;结果、单位错误合扣1分,代入数值不带单位不扣分,K值不带单位不扣分,不考虑有效数字)
(4)升高温度(2分) 增大压强(2分)
【解析】
试题分析:已知4.4g CO2气体与H2经催化加氢生成CH3OH气体和水蒸气时放出4.95kJ的能量,则1mol二氧化碳全部反应放热49.5KJ;结合热化学方程式书写方法写出热化学方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.5KJ/mol;
故答案为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.5KJ/mol;
(1)根据图象可知,a到b过程中氢气的物质的量减小,说明反应向着正向移动,正反应速率大于逆反应速率,
故答案为:大于;
(2)由图1可知,0~1min内氢气的变化量为8mol-6mol=2mol; B.1~3min内氢气的变化量为6mol-3mol=3mol,平均1min变化量为1.5mol; C.3~8min内氢气的变化量为3mol-2mol=1mol,平均1min变化量为0.2mol;D.8~11min达平衡状态,氢气的物质的量不再变化.故1~3min速率增大,8~11min速率最小,
故答案为:A;D;
(3)由图象可知,实线表示的曲线,在8分钟达到平衡状态,此时氢气的物质的量为2mol,氢气的浓度为:2/2=1mol/L氢气的浓度变化为:8/2减去1等于3mol反应前二氧化碳的浓度为:6/2=3mol/L利用化学平衡的三段式可得,
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始物质的量浓度(mol /L) 3 4 0 0
转化物质的量浓度(mol /L) 1 3 1 1
平衡物质的量浓度(mol /L) 2 1 1 1 (1分)
H2的转化率=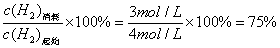 或0.75
或0.75
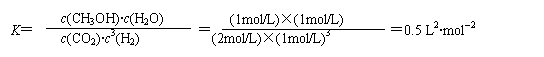

(4)对于可逆反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,正反应是体积减小的放热反应;由图1可知,曲线Ⅰ最先到达平衡,平衡时氢气的物质的量增大,故改变条件应增大反应速率且平衡向逆反应移动,可以采取的措施为:升高温度;曲线Ⅱ到达平衡的时间比原平衡短,平衡时氢气的物质的量减小,故改变条件应增大反应速率且平衡向正反应移动,可以采取的措施为:增大压强或者是增大CO2浓度,
故答案为:升高温度;增大压强.
考点:本题考查化学平衡图象、反应速率大小判断、外界条件对平衡的影响等


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的是
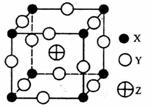
A.ZXY3 B.ZX2Y6 C.ZX4Y8 D.ZX8Y12
查看答案和解析>>
科目:高中化学 来源: 题型:
已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如下图,则下列判断错误的是
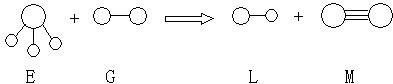
A、G是最活泼的非金属单质 B、L是极性分子
C、E能使紫色石蕊试液变蓝色 D、M化学性质活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
在25℃的条件下,下列叙述正确的是
A.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO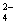 )= c(NH4+)
)= c(NH4+)
B.pH=3的醋酸溶液,稀释至原体积的10倍后pH=4
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,溶液pH<7
D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-) 增大
查看答案和解析>>
科目:高中化学 来源: 题型:
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想,其中不成立的是
A.Mg(NO3)2、NO2、O2 B.MgO、NO2、O2
C.Mg3N2、O2 D.MgO、NO2、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
醋酸是一种常见的弱酸。
(1)假如某醋酸溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10-3mol/L,则此时c(CH3COO-)约为
mol/L;计算此时醋酸的电离平衡常数,写出计算过程。
[注: c平衡(CH3COOH)≈0.10mol/L,水的电离可忽略不计]
(2)为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,准备了以下化学用品:0.20 mol·L-1与0.40 mol·L-1的HCl溶液、0.20 mol·L-1与0.40 mol·L-1的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298 K和308 K。
①酸液都取足量、相同体积,请你帮助完成以下实验设计表:
| 实验 编号 | 温度 (K) | 盐酸浓度 (mol·L-1) | 醋酸浓度 (mol·L-1) | 实验目的 |
| a | 298 | 0.20 | I.实验a和b是探究 对镁与盐酸反应速率的影响; II.实验a和c是探究 对镁与盐酸反应速率的影响; III.实验a和d是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别 | |
| b | 308 | 0.20 | ||
| c | 298 | 0.40 | ||
| d |
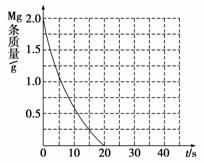 ②若①中实验a镁条消失的时间是20 s,则镁条剩余质量与时间关系图如下图。假设:该反应温度每升高10 ℃,反应速率是原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在此图中大致画出“实验b”、“实验d”的镁条剩余质量与时间关系曲线,请注意必要的标注。
②若①中实验a镁条消失的时间是20 s,则镁条剩余质量与时间关系图如下图。假设:该反应温度每升高10 ℃,反应速率是原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在此图中大致画出“实验b”、“实验d”的镁条剩余质量与时间关系曲线,请注意必要的标注。
(3)镁及其化合物在生产和生活中有着广泛的应用,依据镁的性质、用途等回答下列问题:
已知:①Mg(s)+2H2O(g)===Mg(OH)2(s)+H2(g) ΔH1=-441 kJ·mol-1
②H2O(g)===H2(g)+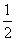 O2(g) ΔH2=+242 kJ·mol-1
O2(g) ΔH2=+242 kJ·mol-1
③Mg(s)+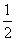 O2(g)===MgO(s) ΔH3=-602 kJ·mol-1。
O2(g)===MgO(s) ΔH3=-602 kJ·mol-1。
则氢氧化镁分解的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.室温下,将pH=2的醋酸与pH=12的NaOH溶液等体积混合,溶液显中性
B.室温下,向pH=3的醋酸溶液加水稀释后,溶液中所有离子浓度均减小
C.向含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
D.向CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com