
设NA为阿伏加德罗常数的数值。下列说法正确的是(用到的相对原子质量:H 1 O16 Al27)
A.18g 2H2O含有10NA个电子
B.1mol苯含有6NA个C-H键
C.常温常压下,22. 4L NH3约含有NA个NH3分子
D.27 g铝片投入足量浓H2SO4中生成1.5NA个SO2分子
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有_____________________。
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如下图所示,请改正图中错误:_____________________________。
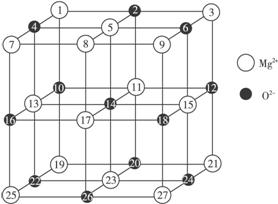
(3)用镁粉、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:______________________________________________-。
(4)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1 266 | 1 534 | 183 |
解释表中氟化物熔点差异的原因:_________________________________________。
(5)人工模拟酶是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当其结合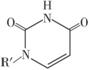 或Cu(Ⅰ)(Ⅰ表示化合价为+1)时,分别形成a和b:
或Cu(Ⅰ)(Ⅰ表示化合价为+1)时,分别形成a和b:
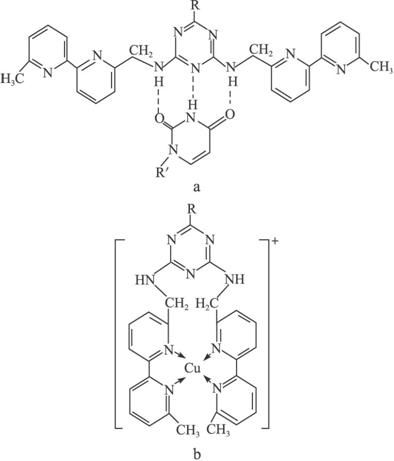
①a中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有____________键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用力的差异________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是
A.液溴和苯分别受热变为气体
B.干冰和氯化铵分别受热变为气体
C.二氧化硅和铁分别受热熔化
D.食盐和葡萄糖分别溶解在水中
查看答案和解析>>
科目:高中化学 来源: 题型:
在25℃的条件下,下列叙述正确的是
A.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO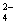 )= c(NH4+)
)= c(NH4+)
B.pH=3的醋酸溶液,稀释至原体积的10倍后pH=4
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,溶液pH<7
D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-) 增大
查看答案和解析>>
科目:高中化学 来源: 题型:
3,5—二甲氧基苯酚是重要的有机合成中间体,其合成反应如下:
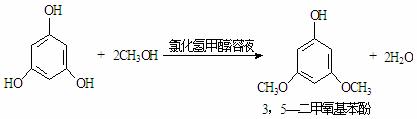
该反应后的混合物含有:3,5—二甲氧基苯酚、甲醇、水和HCl。
已知:甲醇、乙醚和3,5—二甲氧基苯酚的部分物理性质如下表:
| 物质 | 沸点/℃ | 熔点/℃ | 密度(20℃)/(g/cm3) | 溶解性 |
| 甲醇 | 64.7 | — | 0.7915 | 易溶于水 |
| 乙醚 | 34.5 | — | 0.7138 | 难溶于水 |
| 3,5—二甲氧基苯酚 | 172 | 36 | — | 易溶于甲醇、乙醚, 微溶于水 |
现在实验室对反应后的混合物进行分离提纯:
(1)利用与其它物质 差异较大的特点,可先用蒸馏法分离出甲醇,蒸馏操作时使用的玻璃仪器有:酒精灯、 、温度计、冷凝管 、接引管、锥形瓶。
(2)①蒸馏出甲醇后,加入乙醚进行 、 操作,有机层在分液漏斗的 层。
②双项选择:选用乙醚这种试剂的主要原因是( )
A.乙醚易挥发
B.3,5—二甲氧基苯酚在乙醚中溶解度大于在水中的溶解度
C.乙醚难溶于水
D.3,5—二甲氧基苯酚熔点较低
(3)经上述步骤分离得到的有机层再用饱和NaHCO3溶液洗涤,其目的是 。
(4)洗涤完成后,加入无水CaCl2干燥,过滤除去干燥剂,蒸馏除去乙醚,得到固体产物,为进一步提纯固体产物还要进行 操作。
查看答案和解析>>
科目:高中化学 来源: 题型:
醋酸是一种常见的弱酸。
(1)假如某醋酸溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10-3mol/L,则此时c(CH3COO-)约为
mol/L;计算此时醋酸的电离平衡常数,写出计算过程。
[注: c平衡(CH3COOH)≈0.10mol/L,水的电离可忽略不计]
(2)为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,准备了以下化学用品:0.20 mol·L-1与0.40 mol·L-1的HCl溶液、0.20 mol·L-1与0.40 mol·L-1的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298 K和308 K。
①酸液都取足量、相同体积,请你帮助完成以下实验设计表:
| 实验 编号 | 温度 (K) | 盐酸浓度 (mol·L-1) | 醋酸浓度 (mol·L-1) | 实验目的 |
| a | 298 | 0.20 | I.实验a和b是探究 对镁与盐酸反应速率的影响; II.实验a和c是探究 对镁与盐酸反应速率的影响; III.实验a和d是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别 | |
| b | 308 | 0.20 | ||
| c | 298 | 0.40 | ||
| d |
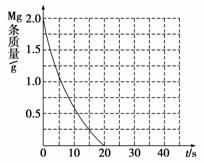 ②若①中实验a镁条消失的时间是20 s,则镁条剩余质量与时间关系图如下图。假设:该反应温度每升高10 ℃,反应速率是原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在此图中大致画出“实验b”、“实验d”的镁条剩余质量与时间关系曲线,请注意必要的标注。
②若①中实验a镁条消失的时间是20 s,则镁条剩余质量与时间关系图如下图。假设:该反应温度每升高10 ℃,反应速率是原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在此图中大致画出“实验b”、“实验d”的镁条剩余质量与时间关系曲线,请注意必要的标注。
(3)镁及其化合物在生产和生活中有着广泛的应用,依据镁的性质、用途等回答下列问题:
已知:①Mg(s)+2H2O(g)===Mg(OH)2(s)+H2(g) ΔH1=-441 kJ·mol-1
②H2O(g)===H2(g)+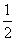 O2(g) ΔH2=+242 kJ·mol-1
O2(g) ΔH2=+242 kJ·mol-1
③Mg(s)+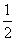 O2(g)===MgO(s) ΔH3=-602 kJ·mol-1。
O2(g)===MgO(s) ΔH3=-602 kJ·mol-1。
则氢氧化镁分解的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)+B(g)  2C(g);ΔH<0,达到平衡时,下列说法正确的是
2C(g);ΔH<0,达到平衡时,下列说法正确的是
A.减小容器体积,平衡不移动 B.加入催化剂,B的转化率增大
C.增大A的浓度,A的转化率增大 D.降低温度,v正 增大,v逆 减小
查看答案和解析>>
科目:高中化学 来源: 题型:
回答下列问题。
(1)如下图,某温度(t℃)时水的图像如下,a点离子积KW= mol2·L-2;该温度下,pH=12的NaOH与pH=2的H2SO4等体积混合,溶液显 性。
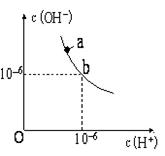
(2)25℃时,向0.1 mol·L-1氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH ,NH4+的物质的量浓度 。(填增大、减小或不变)
(3)体积相等的稀NaOH和CH3COOH溶液混合,若溶液中c(Na+)=c(CH3COO-),则该溶液显 (填“酸性”、“碱性”、“中性”),则混合前c(NaOH)
c(CH3COOH)(填“>”、“<”或“=”)。
(4)常温时,Fe(OH)3的Ksp=1×10-38,要使溶液中的Fe3+沉淀完全(残留在溶液中的c(Fe3+)<10-5 mol·L-1),则溶液的pH最小为 。
(5)用可溶性碳酸盐,可以浸取CaSO4固体,则溶浸过程中会发生反应:
CaSO4(s)+CO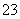 (aq)
(aq)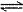 CaCO3(s)+SO
CaCO3(s)+SO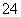 (aq)。
(aq)。
已知298 K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为 (计算结果保留三位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com