
某硫原子的质量是a g,12C原子的质量是b g,若NA只表示阿伏加德罗常数的数值,则下列说法中正确的是
①该硫原子的相对原子质量为aNA
②m g该硫原子的物质的量为m/a mol
③该硫原子的摩尔质量是aNA g·mol-1
④a g该硫原子所含有的电子数为16
A.①②③ B.①②④ C.②③④ D.①③④
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
醋酸是一种常见的弱酸。
(1)假如某醋酸溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10-3mol/L,则此时c(CH3COO-)约为
mol/L;计算此时醋酸的电离平衡常数,写出计算过程。
[注: c平衡(CH3COOH)≈0.10mol/L,水的电离可忽略不计]
(2)为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,准备了以下化学用品:0.20 mol·L-1与0.40 mol·L-1的HCl溶液、0.20 mol·L-1与0.40 mol·L-1的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298 K和308 K。
①酸液都取足量、相同体积,请你帮助完成以下实验设计表:
| 实验 编号 | 温度 (K) | 盐酸浓度 (mol·L-1) | 醋酸浓度 (mol·L-1) | 实验目的 |
| a | 298 | 0.20 | I.实验a和b是探究 对镁与盐酸反应速率的影响; II.实验a和c是探究 对镁与盐酸反应速率的影响; III.实验a和d是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别 | |
| b | 308 | 0.20 | ||
| c | 298 | 0.40 | ||
| d |
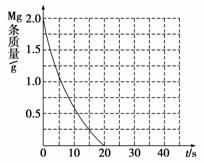 ②若①中实验a镁条消失的时间是20 s,则镁条剩余质量与时间关系图如下图。假设:该反应温度每升高10 ℃,反应速率是原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在此图中大致画出“实验b”、“实验d”的镁条剩余质量与时间关系曲线,请注意必要的标注。
②若①中实验a镁条消失的时间是20 s,则镁条剩余质量与时间关系图如下图。假设:该反应温度每升高10 ℃,反应速率是原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在此图中大致画出“实验b”、“实验d”的镁条剩余质量与时间关系曲线,请注意必要的标注。
(3)镁及其化合物在生产和生活中有着广泛的应用,依据镁的性质、用途等回答下列问题:
已知:①Mg(s)+2H2O(g)===Mg(OH)2(s)+H2(g) ΔH1=-441 kJ·mol-1
②H2O(g)===H2(g)+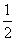 O2(g) ΔH2=+242 kJ·mol-1
O2(g) ΔH2=+242 kJ·mol-1
③Mg(s)+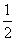 O2(g)===MgO(s) ΔH3=-602 kJ·mol-1。
O2(g)===MgO(s) ΔH3=-602 kJ·mol-1。
则氢氧化镁分解的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.室温下,将pH=2的醋酸与pH=12的NaOH溶液等体积混合,溶液显中性
B.室温下,向pH=3的醋酸溶液加水稀释后,溶液中所有离子浓度均减小
C.向含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
D.向CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
回答下列问题。
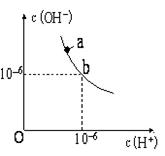
(1)如下图,某温度(t℃)时水的图像如下,a点离子积KW= mol2·L-2;该温度下,pH=12的NaOH与pH=2的H2SO4等体积混合,溶液显 性。
(2)25℃时,向0.1 mol·L-1氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH ,NH4+的物质的量浓度 。(填增大、减小或不变)
(3)体积相等的稀NaOH和CH3COOH溶液混合,若溶液中c(Na+)=c(CH3COO-),则该溶液显 (填“酸性”、“碱性”、“中性”),则混合前c(NaOH)
c(CH3COOH)(填“>”、“<”或“=”)。
(4)常温时,Fe(OH)3的Ksp=1×10-38,要使溶液中的Fe3+沉淀完全(残留在溶液中的c(Fe3+)<10-5 mol·L-1),则溶液的pH最小为 。
(5)用可溶性碳酸盐,可以浸取CaSO4固体,则溶浸过程中会发生反应:
CaSO4(s)+CO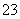 (aq)
(aq)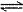 CaCO3(s)+SO
CaCO3(s)+SO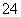 (aq)。
(aq)。
已知298 K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为 (计算结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中书写正确的一组是
① 向明矾溶液中加入Ba(OH)2溶液至A13+ 刚好完全沉淀:
Al3++ SO42-+3OH-+Ba2+= BaSO4↓+Al (OH)3↓
② 氟气和水反应:2F2+2H2O = 4H++4F-+O2
③ 向澄清石灰水中加入少量小苏打溶液:
Ca2++OH-+HCO3- = CaCO3↓+H2O
④ 铜片投入稀HNO3溶液:Cu+NO3-+4H+ = NO↑+2H2O+Cu2+
⑤ 钠与水反应:Na +2 H2O = Na+ +OH— + H2↑
|
⑦ 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O==Fe(OH)3(胶体)+3H+
⑧ 过量氯水与FeI2溶液作用: 2Fe2+ + 2I—+ 2Cl2 = 2 Fe3+ + I2 + 4Cl—
A. ①②③④ B. ③⑦ C. ①③④⑤ D.①④⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉的质量为
A.5.4g B.3.6g C.2.7g D.1.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
橙花醇具有玫瑰及苹果香气,可作为香料,其结构简式如下
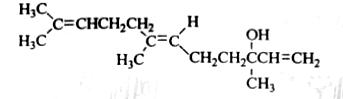
下列关于橙花醇的叙述,错误的是( )
既能发生取代反应,也能发生加成反应
在浓硫酸催化下加热脱水,可生成不止一种四烯烃(分子中含有四个碳碳双键的烯烃)
1mo1橙花醇在氧气中充分燃烧,需消耗470.4L氧气(标准状况)
1mo1橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗240g溴
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com