
下列说法中正确的是
A.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
B.非金属元素呈现的最低化合价,其绝对值等于元素原子的最外层最子数
C.最外层有2个电子的原子都是金属原子
D.最外层有5个电子的原子都是非金属原子
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.1个甘氨酸分子中存在9对共用电子
B.PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构
C.H2S和CS2分子都是含极性键的极性分子
D.熔点由高到低的顺序是:金刚石>碳化硅>晶体硅
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是
A.液溴和苯分别受热变为气体
B.干冰和氯化铵分别受热变为气体
C.二氧化硅和铁分别受热熔化
D.食盐和葡萄糖分别溶解在水中
查看答案和解析>>
科目:高中化学 来源: 题型:
已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如下图,则下列判断错误的是
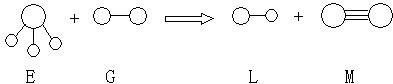
A、G是最活泼的非金属单质 B、L是极性分子
C、E能使紫色石蕊试液变蓝色 D、M化学性质活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
在25℃的条件下,下列叙述正确的是
A.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO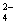 )= c(NH4+)
)= c(NH4+)
B.pH=3的醋酸溶液,稀释至原体积的10倍后pH=4
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,溶液pH<7
D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-) 增大
查看答案和解析>>
科目:高中化学 来源: 题型:
醋酸是一种常见的弱酸。
(1)假如某醋酸溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10-3mol/L,则此时c(CH3COO-)约为
mol/L;计算此时醋酸的电离平衡常数,写出计算过程。
[注: c平衡(CH3COOH)≈0.10mol/L,水的电离可忽略不计]
(2)为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,准备了以下化学用品:0.20 mol·L-1与0.40 mol·L-1的HCl溶液、0.20 mol·L-1与0.40 mol·L-1的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298 K和308 K。
①酸液都取足量、相同体积,请你帮助完成以下实验设计表:
| 实验 编号 | 温度 (K) | 盐酸浓度 (mol·L-1) | 醋酸浓度 (mol·L-1) | 实验目的 |
| a | 298 | 0.20 | I.实验a和b是探究 对镁与盐酸反应速率的影响; II.实验a和c是探究 对镁与盐酸反应速率的影响; III.实验a和d是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别 | |
| b | 308 | 0.20 | ||
| c | 298 | 0.40 | ||
| d |
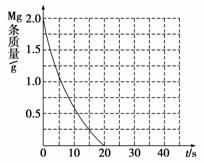 ②若①中实验a镁条消失的时间是20 s,则镁条剩余质量与时间关系图如下图。假设:该反应温度每升高10 ℃,反应速率是原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在此图中大致画出“实验b”、“实验d”的镁条剩余质量与时间关系曲线,请注意必要的标注。
②若①中实验a镁条消失的时间是20 s,则镁条剩余质量与时间关系图如下图。假设:该反应温度每升高10 ℃,反应速率是原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在此图中大致画出“实验b”、“实验d”的镁条剩余质量与时间关系曲线,请注意必要的标注。
(3)镁及其化合物在生产和生活中有着广泛的应用,依据镁的性质、用途等回答下列问题:
已知:①Mg(s)+2H2O(g)===Mg(OH)2(s)+H2(g) ΔH1=-441 kJ·mol-1
②H2O(g)===H2(g)+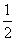 O2(g) ΔH2=+242 kJ·mol-1
O2(g) ΔH2=+242 kJ·mol-1
③Mg(s)+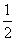 O2(g)===MgO(s) ΔH3=-602 kJ·mol-1。
O2(g)===MgO(s) ΔH3=-602 kJ·mol-1。
则氢氧化镁分解的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉的质量为
A.5.4g B.3.6g C.2.7g D.1.8g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com