
| 240g×0.24g |
| 80g |
| 0.72g |
| 1g |
| 196g×100t×98%×72% |
| 120g×98% |


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| a |
| b |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | (1) | (2) | ||||||
| 3 | (3) | (4) | (5) | (6) | (7) | (8) | (9) | |
| 4 | (10) | (11) | (12) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在标准状况下,2.24L二氯甲烷中所含分子数大于0.1NA |
| B、常温下,0.1mol甲烷与甲醛混合气体中所含碳原子数为0.1NA |
| C、0.1mol硅酸钠溶于水所得溶液中所含阴离子数等于0.1NA |
| D、1LpH=1的醋酸溶液中,CH3COO-和OH-数目之和为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 下列两组实验中的a、b、c都是必修教材中的常见物质,它们都有如图所示的转化关系(图中的箭头“→”表示在一定条件下,物质的转化可以一步完成),试完成下列表格.
下列两组实验中的a、b、c都是必修教材中的常见物质,它们都有如图所示的转化关系(图中的箭头“→”表示在一定条件下,物质的转化可以一步完成),试完成下列表格.
| 序号 | 已知情境 | 化学式 | 对应的离子反应方程式和现象 |
| (1) | 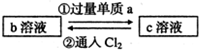 已知b溶液中滴入KSCN溶液后,溶液呈红色. |
a |
反应①的离子方程式 反应②的离子方程式 |
| (2) |  已知b为一种常见的氧化性强酸,其中某非金属元素的最高价为+5. 已知b为一种常见的氧化性强酸,其中某非金属元素的最高价为+5. |
c |
反应③的现象为 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在氯化钴溶液中加入一定量的浓盐酸,溶液颜色的变化是由粉红色变为蓝色 |
| B、已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量的CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4的溶解度比在水中的大 |
| C、在“镀锌铁皮的镀层厚度的测定”实验中,将镀锌铁皮放入稀硫酸中,待产生氢气的速率速率突然减小,可以判断锌镀层已反应完全 |
| D、标定NaOH溶液的基准物质可用草酸、苯甲酸、邻苯二甲酸氢钾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com