
【题目】完成下列计算(注意单位)
(1)在标准状况下,1.7 g氨气所占的体积约为_________L,它与同条件下_____mol H2S含有相同的氢原子数。
(2)在标准状况下,0.5 mol任何气体的体积都约为________ L。
(3)4 g H2与22.4 L(标准状况)CO2相比,所含分子数目较多的是________。
(4)0.01 mol某气体的质量为0.28 g,该气体的摩尔质量为________。
(5)0.3 mol NH3分子中所含氢原子数与____________个H2O分子中所含氢原子数相等。
(6)含0.4 mol Al3+的Al2(SO4)3中所含的SO![]() 的物质的量是________mol。
的物质的量是________mol。
(7)2.3 g Na中含电子的物质的量为___________mol,在跟足量水反应中失去电子的物质的量为____________mol。
【答案】2.24L 0.15mol 11.2L H2 28g·mol-1 2.709×1023 0.6 1.1 0.1
【解析】
(1)在标准状况下,1.7 g氨气所占的体积约为![]() =2.24 L,它与同条件下
=2.24 L,它与同条件下![]()
![]() =0.15mol H2S含有相同的氢原子数。故答案为:2.24L;0.15mol;
=0.15mol H2S含有相同的氢原子数。故答案为:2.24L;0.15mol;
(2)在标准状况下,0.5 mol任何气体的体积都约为![]() =11.2 L。故答案为:11.2L ;
=11.2 L。故答案为:11.2L ;
(3)n(H2)=4g÷2g·mol-1=2mol,V(H2)=2mol×22.4L·mol-1=44.8L,N(H2)=2NA,n(CO2)=22.4L÷22.4L·mol-1=1mol,N(CO2)=NA,则所含分子数多的是H2,故答案为:H2;
(4)0.01 mol某气体的质量为0.28 g,该气体的摩尔质量为![]() =28g·mol-1。故答案为:28g·mol-1;
=28g·mol-1。故答案为:28g·mol-1;
(5)0.3 mol NH3含有0.9molH ,2×n(H2O)=0.9mol, n(H2O)=0.45mol, N=0.45molNA=2.709×1023,0.3 mol NH3分子中所含氢原子数与2.709×1023个H2O分子中所含氢原子数相等。故答案为:2.709×1023;
(6)由物质的构成可知,n(SO42-)=![]() n(Al3+)=
n(Al3+)=![]() ×0.4mol=0.6mol,故答案为:0.6;
×0.4mol=0.6mol,故答案为:0.6;
(7)2.3g Na的物质的量为2.3g÷23g·mol-1=0.1mol,含有电子物质的量为0.1mol×11=1.1mol,Na与水反应生成NaOH与氢气,反应中Na失去电子为0.1mol×1=0.1mol,
故答案为:1.1;0.1;


科目:高中化学 来源: 题型:
【题目】化合物W可用作高分子膨胀剂,一种合成路线如下:
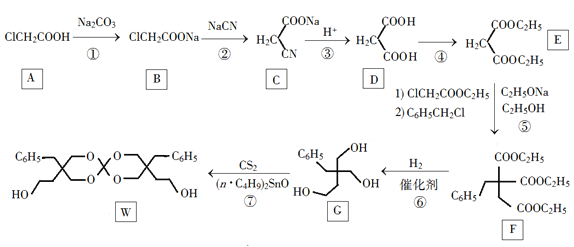
回答下列问题:
(1)A的化学名称为________。
(2)②的反应类型是__________。
(3)反应④所需试剂,条件分别为________。
(4)G的分子式为________。
(5)W中含氧官能团的名称是____________。
(6)写出与E互为同分异构体的酯类化合物的结构简式(核磁共振氢谱为两组峰,峰面积比为1∶1)______________。
(7)苯乙酸苄酯(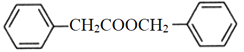 )是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线__________(无机试剂任选)。
)是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线__________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,反应HCO3-+H2O![]() H2CO3+OH-的平衡常数为10-8 。将NH4HCO3溶液和氨水按一定比例混合,可用于浸取废渣中的ZnO。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是
H2CO3+OH-的平衡常数为10-8 。将NH4HCO3溶液和氨水按一定比例混合,可用于浸取废渣中的ZnO。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是
A.0.2mol/L 氨水:c(NH3H2O)>c(NH4+)>c(OH-)>c(H+)
B.0.6 mol/L氨水和0.2 mol/L![]() 溶液等体积混合:c(NH3H2O)+c(CO32-)+c(OH-)=0.3mol/L+2c(H2CO3)+c(H+)
溶液等体积混合:c(NH3H2O)+c(CO32-)+c(OH-)=0.3mol/L+2c(H2CO3)+c(H+)
C.0.2 mol/L氨水和0.2 mol/L![]() 液等体积混合:c(NH4+)+c(NH3H2O)=c(H2CO3)+c(HCO3-)+c(CO32-)
液等体积混合:c(NH4+)+c(NH3H2O)=c(H2CO3)+c(HCO3-)+c(CO32-)
D.0.2mol/L NH4HCO3溶液(pH>7):c(NH4+)>c(HCO3-)>c(H2CO3)>c(NH3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,①6.72L NH3 ②1.204×1023个 H2S ③6.4g CH4 ④0.5mol HCl ,下列关系正确的是( )
A.体积大小: ④>③>②>①B.原子数目: ③>①>④>②
C.密度大小: ④>②>③>①D.质量大小: ④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素及其衍生物在医药、农药、染科等领域有广泛用途。某香豆素衍生物Ⅰ具有抗病毒、抗癌的动多种生物活性,其合成路线如图所示:
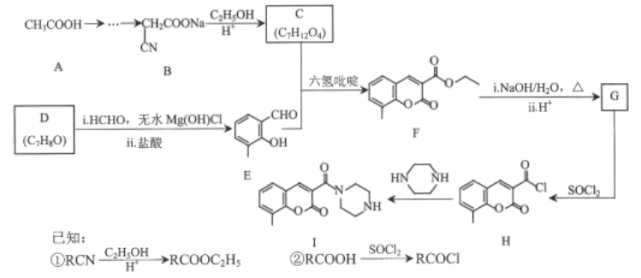 回答下列问题:
回答下列问题:
(1)D的名称是______。F中的含氧官能团的名称是______。
(2)H→I的反应类型为______。
(3)C分子具有对称结构,该化合物的结构简式为______。
(4)F→G中i的化学方程式为______。
(5)E的同分异构体中,满足下列条件的有______种;
①含有苯环
②能发生水解反应
其中核磁共振氢谱有4组峰且峰面积之比为3:2:2:1的结构简式为______(写出一种即可)。
(6)根据上述路线,设计以苯酚、乙醇、丙二酸、甲醛为原料制备![]() 的合成路线______(其他无机试剂自选)。
的合成路线______(其他无机试剂自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为元素周期表的一部分,下列说法不正确的是
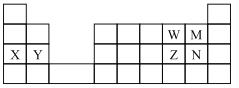
A.原子半径 X>Y
B.X、M的简单离子的电子层结构相同
C.M最高价氧化物的水化物酸性比 N 的强
D.W的简单氢化物比Z的简单氢化物稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸和甲酸甲酯互为同分异构体,其结构式分别如下
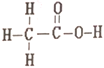 和
和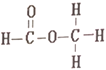
在下列哪种检测仪上显示出的信号是完全相同的
A. 李比希元素分析仪 B. 红外光谱仪
C. 核磁共振仪 D. 质谱仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知和碳元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成化合物的分子式是XY4。试回答:
(1)X元素的原子基态时电子排布式为:___________________________________,Y元素原子最外层电子的电子排布图为:____________。
(2)若X、Y两元素电负性分别为2.1和2.85,试判断XY4中X与Y之间的化学键为________(填“共价键”或“离子键”)。
(3)该化合物的空间结构为______________形,中心原子的轨道杂化类型为__________,分子为______________(填“极性分子”或“非极性分子”)。
(4)该化合物在常温下为液体,该液体微粒间的作用力是____________。
(5)该化合物的沸点与SiCl4比较:________(填化学式)的高,原因是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命名法命名或写出结构简式:
(1)3-甲基-2-丙基-1-戊烯的结构简式为______________________________
(2)![]() 名称为_______________________________________
名称为_______________________________________
(3)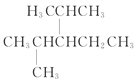 名称为:________________________________
名称为:________________________________
(4)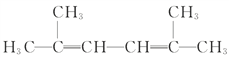 名称为:_______________
名称为:_______________
(5)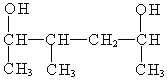 名称为:___________________________
名称为:___________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com