
ΓΨΧβΡΩΓΩœψΕΙΥΊΦΑΤδ―ή…ζΈο‘Ύ“Ϋ“©ΓΔ≈©“©ΓΔ»ΨΩΤΒ»Νλ”ρ”–ΙψΖΚ”ΟΆΨΓΘΡ≥œψΕΙΥΊ―ή…ζΈοΔώΨΏ”–ΩΙ≤ΓΕΨΓΔΩΙΑ©ΒΡΕ·Εύ÷÷…ζΈοΜν–‘Θ§ΤδΚœ≥…¬ΖœΏ»γΆΦΥυ ΨΘΚ
 ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©DΒΡΟϊ≥Τ «______ΓΘF÷–ΒΡΚ§―θΙΌΡήΆ≈ΒΡΟϊ≥Τ «______ΓΘ
Θ®2Θ©HΓζIΒΡΖ¥”Πάύ–ΆΈΣ______ΓΘ
Θ®3Θ©CΖ÷Ή”ΨΏ”–Ε‘≥ΤΫαΙΙΘ§ΗΟΜ·ΚœΈοΒΡΫαΙΙΦρ ΫΈΣ______ΓΘ
Θ®4Θ©FΓζG÷–iΒΡΜ·―ßΖΫ≥Χ ΫΈΣ______ΓΘ
Θ®5Θ©EΒΡΆ§Ζ÷“λΙΙΧε÷–Θ§¬ζΉψœ¬Ν–ΧθΦΰΒΡ”–______÷÷ΘΜ
ΔΌΚ§”–±ΫΜΖ
ΔΎΡήΖΔ…ζΥ°ΫβΖ¥”Π
Τδ÷–ΚΥ¥≈Ι≤’ώ«βΤΉ”–4ΉιΖε«“ΖεΟφΜΐ÷°±»ΈΣ3ΘΚ2ΘΚ2ΘΚ1ΒΡΫαΙΙΦρ ΫΈΣ______Θ®–¥≥ω“Μ÷÷Φ¥Ω…Θ©ΓΘ
Θ®6Θ©ΗυΨί…œ ω¬ΖœΏΘ§…ηΦΤ“‘±ΫΖ”ΓΔ““¥ΦΓΔ±ϊΕΰΥαΓΔΦΉ»©ΈΣ‘≠Νœ÷Τ±Η![]() ΒΡΚœ≥…¬ΖœΏ______Θ®ΤδΥϊΈόΜζ ‘ΦΝΉ‘―ΓΘ©ΓΘ
ΒΡΚœ≥…¬ΖœΏ______Θ®ΤδΥϊΈόΜζ ‘ΦΝΉ‘―ΓΘ©ΓΘ
ΓΨ¥πΑΗΓΩΝΎΦΉ±ΫΖ”Μρ2Θ≠ΦΉΜυ±ΫΖ” θΞΜυ »Γ¥ζΖ¥”Π C2H5COCCH2COOC2H5 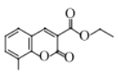 ΘΪNaOH
ΘΪNaOH ![]()
 ΘΪCH3CH2OH 6
ΘΪCH3CH2OH 6  ΓΔ
ΓΔ ΓΔ
ΓΔ
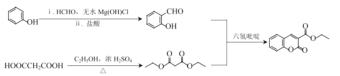
ΓΨΫβΈωΓΩ
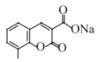
(1)ΗυΨίDΚΆEΒΡΫαΙΙΦρ ΫΕ‘±»“‘ΦΑDΒΡΖ÷Ή” ΫΘ§DΒΡΫαΙΙΦρ ΫΈΣ Θ§ΒΟ≥ωDΒΡΟϊ≥ΤΘΜΗυΨίFΒΡΫαΙΙΦρ ΫΘ§ΆΤ≥ωΚ§―θΙΌΡήΆ≈ΘΜ
Θ§ΒΟ≥ωDΒΡΟϊ≥ΤΘΜΗυΨίFΒΡΫαΙΙΦρ ΫΘ§ΆΤ≥ωΚ§―θΙΌΡήΆ≈ΘΜ
(2)Ε‘±»HΚΆIΒΡΫαΙΙΦρ ΫΘ§ΒΟ≥ωΖ¥”Πάύ–ΆΘΜ
(3)ΗυΨί–≈œΔΔΌΘ§«“CΖ÷Ή”ΨΏ”–Ε‘≥ΤΫαΙΙΘ§ΆΤ≥ωCΒΡΫαΙΙΦρ ΫΘΜ
(4)F÷–Κ§”–θΞΜυΘ§‘ΎΦν»ή“Κ÷–ΖΔ…ζΥ°ΫβΘΜ
(5)ΗυΨίEΒΡΫαΙΙΘ§ΡήΥ°ΫβΘ§ΥΒΟςΚ§”–θΞΜυΘ§»ΜΚσΫχ––Ζ÷ΈωΘΜ
(1) ΗυΨίDΚΆEΒΡΫαΙΙΦρ ΫΕ‘±»“‘ΦΑDΒΡΖ÷Ή” ΫΘ§DΒΡΫαΙΙΦρ ΫΈΣ Θ§DΒΡΟϊ≥ΤΈΣΝΎΦΉ±ΫΖ”Μρ2Θ≠ΦΉΜυ±ΫΖ”ΘΜΗυΨίFΒΡΫαΙΙΦρ ΫΘ§F÷–Κ§―θΙΌΡήΆ≈ «θΞΜυΘΜ
Θ§DΒΡΟϊ≥ΤΈΣΝΎΦΉ±ΫΖ”Μρ2Θ≠ΦΉΜυ±ΫΖ”ΘΜΗυΨίFΒΡΫαΙΙΦρ ΫΘ§F÷–Κ§―θΙΌΡήΆ≈ «θΞΜυΘΜ
(2)Ε‘±»ΫαΙΙΦρ ΫΘ§H÷–ΒΡΓΑCΘ≠ClΓ±ΦϋΖΔ…ζΕœΝ―Θ§Νμ“ΜΖ¥”ΠΈο÷–“ΜΗωΓΑNΘ≠HΓ±ΕœΝ―Θ§ΕœΝ―œ¬ά¥ΒΡClΚΆHΫαΚœ≥…HClΘ§Τδ”ύΫαΚœ≥…IΘ§ΗΟΖ¥”Πάύ–ΆΈΣ»Γ¥ζΖ¥”ΠΘΜ
(3)ΗυΨί–≈œΔΔΌΘ§«“CΈΣΕ‘≥ΤΫαΙΙΘ§ΆΤ≥ωCΒΡΫαΙΙΦρ ΫΈΣC2H5COCCH2COOC2H5ΘΜ
(4)ΗυΨί–≈œΔΔΎΘ§ΒΟ≥ωG÷–”ΠΚ§”–τ»ΜυΘ§ΗυΨίHΒΡΫαΙΙΦρ ΫΘ§FΓζG÷Μ”–1Ηωτ»ΜυΖΔ…ζΕœΝ―Θ§Φ¥”Π «”κΧΦΧΦΥΪΦϋΝ§Ϋ”ΒΡΡ«ΗωθΞΜυΕœΝ―Θ§Φ¥Ζ¥”ΠiΒΡΖ¥”ΠΖΫ≥Χ ΫΈΣ ΘΪNaOH
ΘΪNaOH ![]()
 ΘΪCH3CH2OHΘΜ
ΘΪCH3CH2OHΘΜ
(5)Κ§”–±ΫΜΖΘ§ΡήΖΔ…ζΥ°ΫβΖ¥”ΠΘ§ΗυΨίEΒΡΫαΙΙΦρ ΫΘ§ΖϊΚœ“Σ«σΒΡΆ§Ζ÷“λΙΙΧε÷–Κ§”–θΞΜυΘ§ ΓΔ
ΓΔ ΓΔ
ΓΔ Θ®ΝΎΓΔΦδΓΔΕ‘»ΐ÷÷Θ©ΓΔ
Θ®ΝΎΓΔΦδΓΔΕ‘»ΐ÷÷Θ©ΓΔ Θ§Ι≤”–6÷÷ΘΜ”–4ΉιΖεΘ§ΥΒΟς”–4÷÷≤ΜΆ§ΒΡ«β‘≠Ή”Θ§«“«β‘≠Ή”Ηω ΐ±»ΈΣ3ΘΚ2ΘΚ2ΘΚ1Θ§Φ¥ΖϊΚœΧθΦΰΒΡ «
Θ§Ι≤”–6÷÷ΘΜ”–4ΉιΖεΘ§ΥΒΟς”–4÷÷≤ΜΆ§ΒΡ«β‘≠Ή”Θ§«“«β‘≠Ή”Ηω ΐ±»ΈΣ3ΘΚ2ΘΚ2ΘΚ1Θ§Φ¥ΖϊΚœΧθΦΰΒΡ « ΓΔ
ΓΔ ΓΔ
ΓΔ ΘΜ
ΘΜ
(6)ΗυΨίΝς≥ΧΘ§÷Τ±Η![]() Θ§–η“ΣΒΡΈο÷ «
Θ§–η“ΣΒΡΈο÷ « ΚΆC2H5COCCH2COOC2H5Θ§ΗυΨί…œ ωΝς≥Χ÷–DΓζEΘ§“ρ¥Υ÷Τ±Η
ΚΆC2H5COCCH2COOC2H5Θ§ΗυΨί…œ ωΝς≥Χ÷–DΓζEΘ§“ρ¥Υ÷Τ±Η Θ§–η“Σ”Ο±ΫΖ”‘ΎΦΉ»©Θ§ΈόΥ°Mg(OH)Clœ¬÷Τ±ΗΘ§÷Τ±ΗC2H5COCCH2COOC2H5Θ§”ΟHOOCCH2COOH”κC2H5OH‘Ύ≈®ΝρΥαΒΡΉς”Οœ¬Ϋχ––Θ§“ρ¥Υ¬ΖœΏ «
Θ§–η“Σ”Ο±ΫΖ”‘ΎΦΉ»©Θ§ΈόΥ°Mg(OH)Clœ¬÷Τ±ΗΘ§÷Τ±ΗC2H5COCCH2COOC2H5Θ§”ΟHOOCCH2COOH”κC2H5OH‘Ύ≈®ΝρΥαΒΡΉς”Οœ¬Ϋχ––Θ§“ρ¥Υ¬ΖœΏ « ΓΘ
ΓΘ



| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ”ΟΒγΫβΡρΥΊ[CO(NH3)2]ΒΡΦν–‘»ή“Κ÷Τ«βΤχΒΡΉΑ÷Ο»γΆΦΥυ ΨΓΘœ¬Ν–ΥΒΖ®¥μΈσΒΡ «
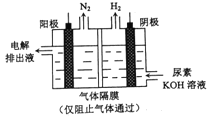
A. ΈΣ‘ω«ΩΒΦΒγ–‘Θ§Ω…”ΟΫπ τΆ≠Ής―τΦΪ
B. ΒγΫβΙΐ≥Χ÷–“θΓΔ―τΦΪ≤ζ…ζΒΡΤχΧεΈο÷ ΒΡΝΩ÷°±»ΈΣ3ΘΚ1
C. “θΦΪΒΡΒγΦΪΖ¥”Π ΫΈΣΘΚ2H2O+2e-=H2+2OH-
D. ―τΦΪΒΡΒγΦΪΖ¥”Π ΫΈΣΘΚCO(NH2)2-6e-+8OH-=CO32-+N2+6H2O
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ5-τ«…ΪΑΖΘ§Ήν‘γ «¥”―Σ«ε÷–ΖΔœ÷ΒΡΘ§”÷Οϊ―Σ«εΥΊΓΘΙψΖΚ¥φ‘Ύ”Ύ≤Η»ιΕ·ΈοΉι÷·÷–Θ§ «“Μ÷÷“÷÷Τ–‘…ώΨ≠Βί÷ ΓΘœ¬Ν–”–ΙΊΥΒΖ®’ΐ»ΖΒΡ «
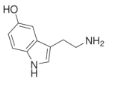
“―÷ΣΘΚΈε‘ΣΒΣ‘”ΜΖ…œΒΡ‘≠Ή”‘ΎΆ§“ΜΤΫΟφ…œΓΘ
A.“ΜΕ®Ι≤ΤΫΟφΒΡ C ‘≠Ή””– 9 Ηω
B.±ΫΜΖ…œΒΡ“Μ¬»¥ζΈο”– 2 ÷÷
C.Ζ÷Ή”÷–Κ§”–ΥΡ÷÷ΙΌΡήΆ≈Θ§Ω…ΖΔ…ζΦ”≥…ΓΔœϊ»ΞΓΔ÷–ΚΆΒ»Ζ¥”Π
D.5-τ«…ΪΑΖΒΡΖ÷Ή” ΫΈΣ C10H10N2O
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
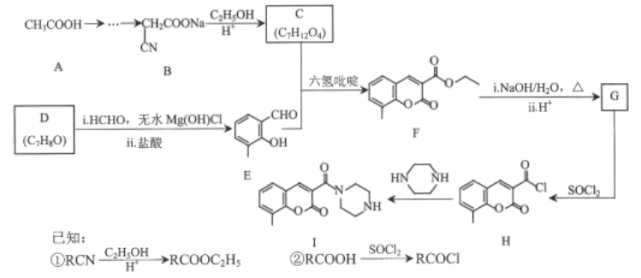
ΓΨΧβΡΩΓΩ”–ΜζΈοGΘ®![]() Θ©ΡήΧμΦ”‘Ύ―άΗύΓΔΩΎœψΧ«÷–“‘‘ω«ΩœψΤχΓΘœ¬Ν–ΙΊ”ΎGΒΡΥΒΖ®¥μΈσΒΡ «Θ®ΓΓΓΓΘ©
Θ©ΡήΧμΦ”‘Ύ―άΗύΓΔΩΎœψΧ«÷–“‘‘ω«ΩœψΤχΓΘœ¬Ν–ΙΊ”ΎGΒΡΥΒΖ®¥μΈσΒΡ «Θ®ΓΓΓΓΘ©
A.Ζ÷Ή” ΫΈΣC11H14O
B.“Μ¬»¥ζΈο”–8÷÷Θ®≤ΜΩΦ¬«ΝΔΧε“λΙΙΘ©
C.Υυ”–ΧΦ‘≠Ή”Ω…Ρή‘ΎΆ§“ΜΤΫΟφ…œ
D.ΡήΖΔ…ζ»Γ¥ζΓΔΦ”≥…ΓΔ―θΜ·Ζ¥”Π
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡΤάκΉ”Βγ≥Ίœύ±»ο°άκΉ”Βγ≥ΊΨΏ”–ΗΏΑ≤»ΪΓΔ≥Λ ΌΟϋΓΔΒΆ≥…±ΨΒΡΧΊΒψΘ§”–Άϊ≥…ΈΣœ¬“Μ¥ζΒγ≥ΊΓΘΡ≥ΡΤάκΉ”Βγ≥ΊΖ≈Βγ ±ΒΡΉήΖ¥”ΠΈΣNaΘ®1-xΘ©MO2+NaxCn®TNaMO2+nCΘ§»γΆΦ±μ ΨΤδ≥δΒγΙΐ≥ΧΓΘ”–ΙΊΗΟΒγ≥ΊΒΡΥΒΖ®¥μΈσΒΡ «Θ®ΓΓΓΓΘ©
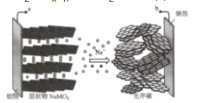
A.≥δΒγ ±Θ§a”κΆβΦ”Βγ‘¥’ΐΦΪœύΝ§
B.Ζ≈Βγ ±Θ§ΆβΒγ¬ΖΒγΉ””…bΝςœρa
C.≥δΒγ ±Θ§Έό–ρΧΦ…œΖΔ…ζΒΡΖ¥”ΠΈΣnC+xNa++xe-®TNaxCn
D.”ΟΗΟΒγ≥ΊΒγΫβΨΪΝΕΆ≠Θ§Β±Βγ≥Ί÷–«®“Τ1molNa+ ±Θ§άμ¬έ…œΩ…ΜώΒΟ64g¥ΩΆ≠
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΆξ≥…œ¬Ν–ΦΤΥψΘ®ΉΔ“βΒΞΈΜΘ©
(1)‘Ύ±ξΉΦΉ¥Ωωœ¬Θ§1.7 gΑ±ΤχΥυ’ΦΒΡΧεΜΐ‘ΦΈΣ_________LΘ§Υϋ”κΆ§ΧθΦΰœ¬_____mol H2SΚ§”–œύΆ§ΒΡ«β‘≠Ή” ΐΓΘ
(2)‘Ύ±ξΉΦΉ¥Ωωœ¬Θ§0.5 mol»ΈΚΈΤχΧεΒΡΧεΜΐΕΦ‘ΦΈΣ________ LΓΘ
(3)4 g H2”κ22.4 L(±ξΉΦΉ¥Ωω)CO2œύ±»Θ§ΥυΚ§Ζ÷Ή” ΐΡΩΫœΕύΒΡ «________ΓΘ
(4)0.01 molΡ≥ΤχΧεΒΡ÷ ΝΩΈΣ0.28 gΘ§ΗΟΤχΧεΒΡΡΠΕϊ÷ ΝΩΈΣ________ΓΘ
(5)0.3 mol NH3Ζ÷Ή”÷–ΥυΚ§«β‘≠Ή” ΐ”κ____________ΗωH2OΖ÷Ή”÷–ΥυΚ§«β‘≠Ή” ΐœύΒ»ΓΘ
(6)Κ§0.4 mol Al3ΘΪΒΡAl2(SO4)3÷–ΥυΚ§ΒΡSO![]() ΒΡΈο÷ ΒΡΝΩ «________molΓΘ
ΒΡΈο÷ ΒΡΝΩ «________molΓΘ
(7)2.3 g Na÷–Κ§ΒγΉ”ΒΡΈο÷ ΒΡΝΩΈΣ___________molΘ§‘ΎΗζΉψΝΩΥ°Ζ¥”Π÷– ß»ΞΒγΉ”ΒΡΈο÷ ΒΡΝΩΈΣ____________molΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «
A.±ΫΒΡδεΜ· Β―ι÷––η“ΣΒΡ“«Τς”–ΨΤΨΪΒΤΘ§»ΐΨ±…’ΤΩΘ§άδΡΐΙήΘ§ΉΕ–ΈΤΩΒ»
B.ΡρΥΊΚΆΦΉ»©‘Ύ“ΜΕ®ΧθΦΰœ¬ΡήΖ¥”Π…ζ≥…ΗΏΖ÷Ή”≤ΡΝœκε»© ς÷§
C.ΟΚΒΡΤχΜ· «÷ΗΗΏΈ¬œ¬ΟΚ”κΥ°’τΤχΉς”ΟΒΟΒΫCOΓΔH2ΓΔCH4 Β»ΤχΧε
D. ·”ΆΒΡΦ”ΙΛΙΐ≥Χ÷–Θ§”–¥ΏΜ·÷Ί’ϊΚΆΦ”«βΝ―Μ·Β»ΙΛ“’Θ§¥ΏΜ·÷Ί’ϊ «ΜώΒΟΖΦœψΧΰΒΡ÷ς“ΣΆΨΨΕ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥“ΜΜ·ΚœΈοΒΡΖ÷Ή” ΫΈΣAB2Θ§A τΔωAΉε‘ΣΥΊΘ§B τΔςAΉε‘ΣΥΊΘ§AΚΆB‘ΎΆ§“Μ÷ήΤΎΘ§ΥϋΟ«ΒΡΒγΗΚ–‘÷ΒΖ÷±πΈΣ3.44ΚΆ3.98Θ§“―÷ΣAB2Ζ÷Ή”ΒΡΦϋΫ«ΈΣ103.3ΓΘΓΘœ¬Ν–ΆΤΕœ≤Μ’ΐ»ΖΒΡ «Θ® Θ©
A.AB2Ζ÷Ή”ΒΡΩ’ΦδΙΙ–ΆΈΣΓΑVΓ±–Έ
B.A---BΦϋΈΣΦΪ–‘Ι≤ΦέΦϋΘ§AB2Ζ÷Ή”ΈΣΖ«ΦΪ–‘Ζ÷Ή”
C.AB2”κH2Oœύ±»Θ§AB2ΒΡ»έΒψΓΔΖ–Βψ±»H2OΒΡΒΆ
D.AB2Ζ÷Ή”÷–Έό«β‘≠Ή”Θ§Ζ÷Ή”Φδ≤ΜΡή–Έ≥…«βΦϋΘ§ΕχH2OΖ÷Ή”ΦδΡή–Έ≥…«βΦϋ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΦΉ¥ΦΓΔ““¥Φά¥‘¥ΖαΗΜΓΔΦέΗώΒΆΝ°ΓΔ‘Υ δ÷ϋ¥φΖΫ±ψΘ§ΕΦ «÷Ί“ΣΒΡΜ·ΙΛ‘≠ΝœΘ§”–Ή≈÷Ί“ΣΒΡ”ΟΆΨΚΆ”Π”Ο«ΑΨΑΘ§Ω…“‘”ΟΕύ÷÷ΖΫΖ®Κœ≥…ΓΘ
IΘ°”ΟCO2…ζ≤ζΦΉ¥ΦΓΔ““¥Φ
(1)“―÷ΣΘΚH2ΒΡ»Φ…’»»ΈΣ-285.8 kJ/molΘ§CH3OH(l)ΒΡ»Φ…’»»ΈΣ-725.8kJ/molΘ§CH3OH(g)=CH3OH(l) ΓςH= -37.3 kJ/molΘ§‘ρCO2(g)+3H2(g)=CH3OH(g)+ H2O(1) ΓςH=____kJ/molΓΘ
(2)ΫΪCO2ΚΆH2Α¥Έο÷ ΒΡΝΩ÷°±»1:3≥δ»κΧεΜΐΈΣ2.0LΒΡΚψ»ίΟή±’»ίΤς÷–Ζ¥”Π[…ζ≥… H2O(g)]Θ§»γΆΦ1±μ Ψ―Ι«ΩΈΣ0.1 MPaΚΆ5.0 MPaœ¬CO2ΉΣΜ·¬ ΥφΈ¬Ε»ΒΡ±δΜ·ΙΊœΒΓΘ

ΔΌaΓΔbΝΫΒψΜ·―ßΖ¥”ΠΥΌ¬ Ζ÷±π”ΟVaΓΔVbΘ§±μ ΨΘ§‘ρVa ___VbΘ®ΧνΓΑ¥σ”ΎΓ±ΓΔΓΑ–Γ”ΎΓ±ΜρΓΑΒ»”ΎΓ±Θ©ΓΘ
ΔΎΝ–≥ωaΒψΕ‘”ΠΒΡΤΫΚβ≥Θ ΐ±μ¥ο ΫK= ____________________ΓΘ
(3)‘Ύ1.0 LΚψ»ίΟή±’»ίΤς÷–ΆΕ»κ1 mol CO2ΚΆ2.75 mol H2ΖΔ…ζΖ¥”ΠΘΚCO2(g)+3H2(g) ![]() CH3OH (g)+H2O(g)Θ§ Β―ι≤βΒΟ≤ΜΆ§Έ¬Ε»ΦΑ―Ι«Ωœ¬Θ§ΤΫΚβ ±ΦΉ¥ΦΒΡΈο÷ ΒΡΝΩ±δΜ·»γΆΦ2Υυ ΨΘ§œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «_____ΓΘ
CH3OH (g)+H2O(g)Θ§ Β―ι≤βΒΟ≤ΜΆ§Έ¬Ε»ΦΑ―Ι«Ωœ¬Θ§ΤΫΚβ ±ΦΉ¥ΦΒΡΈο÷ ΒΡΝΩ±δΜ·»γΆΦ2Υυ ΨΘ§œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «_____ΓΘ
A.ΗΟΖ¥”ΠΒΡ’ΐΖ¥”ΠΈΣΖ≈»»Ζ¥”Π
BΘ°―Ι«Ω¥σ–ΓΙΊœΒΈΣp1ΘΦp2ΘΦp3
CΘ°MΒψΕ‘”ΠΒΡΤΫΚβ≥Θ ΐKΒΡ÷Β‘ΦΈΣ1.04ΓΝ10Θ≠2
DΘ°‘Ύp2ΦΑ512 K ±Θ§ΆΦ÷–NΒψΠ‘(’ΐ)ΘΦΠ‘(Ρφ)
(4)CO2¥ΏΜ·Φ”«βΚœ≥…““¥ΦΒΡΖ¥”ΠΈΣΘΚ2CO2(g)+6H2(g) ![]() C2H5OH(g) +3H2O(g) ΓςHΘΜm¥ζ±μΤπ Φ ±ΒΡΆΕΝœ±»Θ§Φ¥mΘΫ
C2H5OH(g) +3H2O(g) ΓςHΘΜm¥ζ±μΤπ Φ ±ΒΡΆΕΝœ±»Θ§Φ¥mΘΫ![]()

ΔΌΆΦ3÷–ΆΕΝœ±»œύΆ§Θ§Έ¬Ε»T3ΘΨT2ΘΨT1Θ§‘ρΗΟΖ¥”ΠΒΡλ ±δΓςH____0Θ®ΧνΓΑΘΨΓ±ΓΔΓΑΘΦΓ±Θ©ΓΘ
ΔΎm=3 ±Θ§ΗΟΖ¥”Π¥οΒΫΤΫΚβΉ¥Χ§Κσp(Ήή)=20a MPaΘ§Κψ―ΙΧθΦΰœ¬ΗςΈο÷ ΒΡΈο÷ ΒΡΝΩΖ÷ ΐ”κΈ¬Ε»ΒΡΙΊœΒ»γΆΦ4Υυ ΨΘ§‘ρ«ζœΏb¥ζ±μΒΡΈο÷ ΈΣ_________Θ®ΧνΜ·―ß ΫΘ©Θ§T4Έ¬Ε» ±Θ§Ζ¥”Π¥οΒΫΤΫΚβ ±Έο÷ dΒΡΖ÷―Ιp(d)=___________ΓΘ
ΔρΘ°ΦΉ¥ΦΒΡ”Π”Ο
(5)“‘ΦΉ¥ΦΈΣ÷ς“Σ‘≠ΝœΘ§ΒγΜ·―ßΚœ≥…ΧΦΥαΕΰΦΉθΞΒΡΙΛΉς‘≠άμ»γΆΦ5Υυ ΨΓΘ

άκΉ”ΫΜΜΜΡΛaΈΣ_____Θ®ΧνΓΑ―τΡΛΓ±ΓΔΓΑ“θΡΛΓ±Θ©Θ§―τΦΪΒΡΒγΦΪΖ¥”Π ΫΈΣ______________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com