
【题目】甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
I.用CO2生产甲醇、乙醇
(1)已知:H2的燃烧热为-285.8 kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,CH3OH(g)=CH3OH(l) △H= -37.3 kJ/mol,则CO2(g)+3H2(g)=CH3OH(g)+ H2O(1) △H=____kJ/mol。
(2)将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应[生成 H2O(g)],如图1表示压强为0.1 MPa和5.0 MPa下CO2转化率随温度的变化关系。

①a、b两点化学反应速率分别用Va、Vb,表示,则Va ___Vb(填“大于”、“小于”或“等于”)。
②列出a点对应的平衡常数表达式K= ____________________。
(3)在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g)+3H2(g) ![]() CH3OH (g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是_____。
CH3OH (g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是_____。
A.该反应的正反应为放热反应
B.压强大小关系为p1<p2<p3
C.M点对应的平衡常数K的值约为1.04×10-2
D.在p2及512 K时,图中N点υ(正)<υ(逆)
(4)CO2催化加氢合成乙醇的反应为:2CO2(g)+6H2(g) ![]() C2H5OH(g) +3H2O(g) △H;m代表起始时的投料比,即m=
C2H5OH(g) +3H2O(g) △H;m代表起始时的投料比,即m=![]()

①图3中投料比相同,温度T3>T2>T1,则该反应的焓变△H____0(填“>”、“<”)。
②m=3时,该反应达到平衡状态后p(总)=20a MPa,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为_________(填化学式),T4温度时,反应达到平衡时物质d的分压p(d)=___________。
Ⅱ.甲醇的应用
(5)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图5所示。

离子交换膜a为_____(填“阳膜”、“阴膜”),阳极的电极反应式为______________。
【答案】-94.3 大于 K=![]() AC < CO2 2.5a MPa 阳膜 2CH3OH+CO2e=(CH3O)2CO+2H+
AC < CO2 2.5a MPa 阳膜 2CH3OH+CO2e=(CH3O)2CO+2H+
【解析】
(1)①H2(g)+![]() O2(g)=H2O(l)△H=-285.8kJ/mol,
O2(g)=H2O(l)△H=-285.8kJ/mol,
②CH3OH(g)=CH3OH(l)△H= -37.3kJ/mol,
③CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol,
O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol,
由盖斯定律①×3-③-②;可得CO2(g)+3H2(g)=CH3OH(g)+H2O(1)△H=-94.3kJ/mol;
(2)①a、b两点温度相同,正反应为气体体积减小的反应,增大压强平衡正向移动,二氧化碳转化率增大,故压强曲线A大于曲线B,压强越大反应速率越快,故反应速率Va大于Vb;
②a点发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),平衡常数表达式K=![]() ;
;
(3)A.由图可知,随着温度升高,平衡时甲醇的物质的量在减小,所以升温平衡向逆反应方向移动,则正反应为放热反应,故A正确;
B.由图可知,作一条等温线,因为该反应为气体体积减小的反应,压强越大,平衡时甲醇的物质的量也越大,所以p1>p2>p3,故B错误;
C.由图可知,M点对应的甲醇产量为0.25mol,则

所以K=![]() =1.04×102;故C正确;
=1.04×102;故C正确;
D.由图可知,在p2及512K时,N点甲醇的物质的量还小于平衡时的量,所以应该正向移动,则v(正)>v(逆),故D错误;
答案选AC;
(4)①由图3可知,相同压强下,温度越高氢气转化率越小,说明升高温度反应向逆向移动,正反应放热,△H<0;
②温度升高,反应逆向进行,所以产物的物质的量是逐渐减少的,反应物的物质的量增大,由图可知,根据反应计量系数关系,曲线a代表的物质为H2,b表示CO2,c为H2O,d为C2H5OH;设开始氢气的投入量是3nmol,则二氧化碳是nmol,二氧化碳的转化量是x,
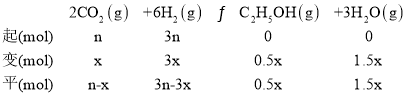
N点b、d的物质的量分数相同,所以n-x=0.5x,解得x=![]() n,总物质的量是n-x+3n-3x+0.5x+1.5x=
n,总物质的量是n-x+3n-3x+0.5x+1.5x=![]() n,压强之比等于物质的量之比,组分平衡分压=总压×该组分的物质的量分数,d为C2H5OH,达到平衡时乙醇的压p(乙醇)=
n,压强之比等于物质的量之比,组分平衡分压=总压×该组分的物质的量分数,d为C2H5OH,达到平衡时乙醇的压p(乙醇)= =2.5a MPa;
=2.5a MPa;
(5)由图分析可知氧气得电子,发生还原反应,与氢离子结合生成水,该电极为阴极,则氢离子要透过交换膜a在阴极与氧气结合,则交换膜a为阳离子交换膜;阳极上是甲醇和一氧化碳反应失电子发生氧化反应,电极反应为:2CH3OH+CO-2e=(CH3O)2CO+2H+。


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
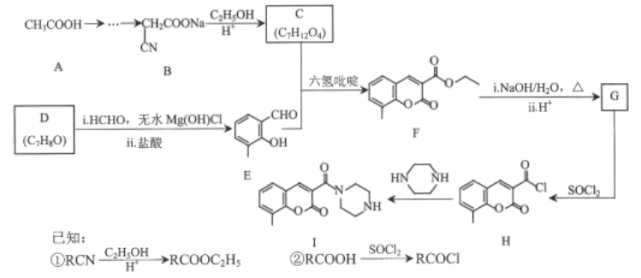
【题目】香豆素及其衍生物在医药、农药、染科等领域有广泛用途。某香豆素衍生物Ⅰ具有抗病毒、抗癌的动多种生物活性,其合成路线如图所示:
 回答下列问题:
回答下列问题:
(1)D的名称是______。F中的含氧官能团的名称是______。
(2)H→I的反应类型为______。
(3)C分子具有对称结构,该化合物的结构简式为______。
(4)F→G中i的化学方程式为______。
(5)E的同分异构体中,满足下列条件的有______种;
①含有苯环
②能发生水解反应
其中核磁共振氢谱有4组峰且峰面积之比为3:2:2:1的结构简式为______(写出一种即可)。
(6)根据上述路线,设计以苯酚、乙醇、丙二酸、甲醛为原料制备![]() 的合成路线______(其他无机试剂自选)。
的合成路线______(其他无机试剂自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量CO2) 直接制备二甲醚,其中的主要过程包括以下四个反应:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1=-90.1kJ·mol-1
CH3OH(g) ΔH1=-90.1kJ·mol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-49.0kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-49.0kJ·mol-1
③CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH3=+41.1kJ·mol-1
CO(g)+H2O(g) ΔH3=+41.1kJ·mol-1
④2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH4=-24.5kJ·mol-1。试回答下列问题:
CH3OCH3(g)+H2O(g) ΔH4=-24.5kJ·mol-1。试回答下列问题:
(1)由H2和CO直接制备二甲醚的热化学方程式:2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) ΔH =_______kJ·mol-1;该反应可以自发进行的条件为________________。
CH3OCH3(g)+H2O(g) ΔH =_______kJ·mol-1;该反应可以自发进行的条件为________________。
(2)将1.0mol CO2 和 3.0mol H2 充入2L恒容密闭容器中,使其仅按反应②进行,在不同催化剂作用下,相同时间内 CO2 的转化率随温度变化如图所示。下列说法正确的是______________
A.T3对应的平衡常数小于T4对应的平衡常数
B.根据图中曲线分析,催化剂I的催化效果最好
C.b点v(正)可能等于v(逆)
D.a点的转化率比c点高可能的原因是该反应为放热反应,升温平衡逆向移动,转化率降低
(3)若CO2和H2仅发生反应②和③,研究表明:在其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性,使用该催化剂,按 n(CO2):n(H2)=1:3(总量为a mol)投料于恒容密闭容器中进行反应,CO2的平衡转化率和甲醇的选择率(甲醇的选择率:转化的 CO2中生成甲醇的物质的量分数)随温度的变化趋势如图所示:(忽略温度对催化剂的影响)
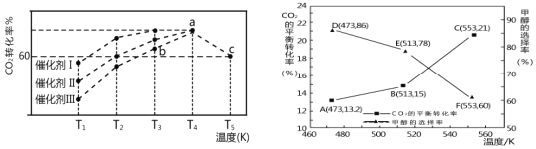
①在553K达到平衡时,反应体系内甲醇的物质的量为_________mol。
②随着温度的升高,CO2的平衡转化率增加但甲醇的选择率降低,请分析其原因:____________________________ 。
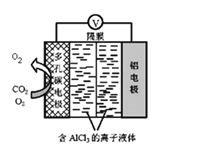
(4)O2催化辅助的 Al-CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。 则电池的正极反应式:6O2+6e-=6O2-和____________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
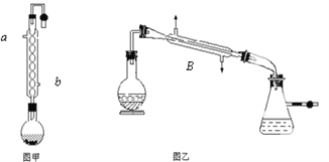
【题目】实验室合成乙酸乙酯的步骤如下:在图甲的圆底烧瓶内加入乙醇、浓硫酸和乙酸,加热回流一段时间,然后换成图乙装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。
请回答下列问题
(1)图甲中冷凝水从______(a或b)进,图乙中B装置的名称为_______;
(2)图甲在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入沸石,目的是_______;
(3)反应中加入过量的乙醇,目的是_______;
(4)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程图:
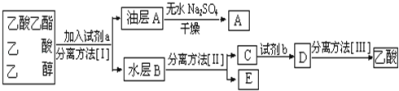
则试剂a是______,分离方法I是_______,分离方法II是_______,产物E是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:①pOH=-lgc(OH-);②N2H4 +H2O![]() N2H5++OH-、N2H5++H2O
N2H5++OH-、N2H5++H2O![]() N2H62++OH-,分别对应有pOH1和pOH2。常温下,将盐酸滴加到N2H4的水溶液中,混合溶液中pOH随离子浓度变化的关系如图所示。下列叙述错误的是
N2H62++OH-,分别对应有pOH1和pOH2。常温下,将盐酸滴加到N2H4的水溶液中,混合溶液中pOH随离子浓度变化的关系如图所示。下列叙述错误的是
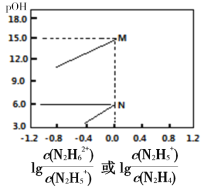
A.曲线M表示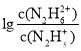 变化关系
变化关系
B.N2H4与硫酸形成的酸式盐的化学式为N2H5HSO4
C.pOH1>pOH2
D.反应N2H5+ + H2O ![]() N2H62+ + OH-的K=10-15
N2H62+ + OH-的K=10-15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命名法命名或写出结构简式:
(1)3-甲基-2-丙基-1-戊烯的结构简式为______________________________
(2)![]() 名称为_______________________________________
名称为_______________________________________
(3)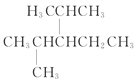 名称为:________________________________
名称为:________________________________
(4)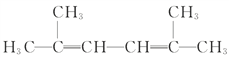 名称为:_______________
名称为:_______________
(5)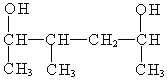 名称为:___________________________
名称为:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用0.1 mol/LNaOH溶液滴定某二元弱酸H2A,H2A被滴定分数、pH及物种分布分数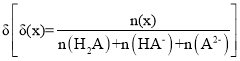 如图所示:
如图所示:
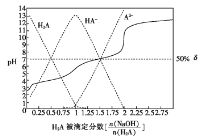
下列说法错误的是
A.用NaOH溶液滴定0.1 mol·L-1NaHA溶液可用酚酞作指示剂
B.0.1 mol·L-1NaA溶液中: ![]()
C.0.1 mol·L-1NaHA溶液中: ![]()
D.H2A 的K2=1×10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,常温下CH3COOH和NH3·H2O的电离常数均为1.8×10-5。某小组进行如图三组实验且实验II、III中Mg(OH)2固体均溶解。下列说法正确的是
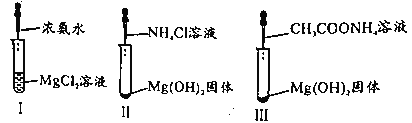
A.I中现象说明NH3·H2O碱性强于Mg(OH)2
B.II中总反应为2H++Mg(OH)2=Mg2++2H2O
C.实验II、III研究NH4+对Mg(OH)2溶解的作用原理
D.III中CH3COONH4浓度越小,越有利于沉淀的溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO42—,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A.Cl-、Br-、CrO42—B.CrO42—、Br-、Cl-C.Br-、Cl-、CrO42— D.Br-、CrO42—、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com