
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO42—,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A.Cl-、Br-、CrO42—B.CrO42—、Br-、Cl-C.Br-、Cl-、CrO42— D.Br-、CrO42—、Cl-
 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀。根据上述实验事实,下列说法中,不正确的是
A.溶解度 MnS<PbS
B.MnS存在沉淀溶解平衡 MnS(s)![]() Mn2+(aq) + S2-(aq)
Mn2+(aq) + S2-(aq)
C.Cu2+转化为沉淀的原理为 MnS(s) + Cu2+(aq)=CuS(s) + Mn2+(aq)
D.沉淀转化能用于除去溶液中的某些杂质离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝、铁是三种重要金属,它们的单质和化合物应用十分广泛。回答下列问题:
(1)镁、铝第一电离能大小的关系是I1(Mg)_________I1(Al),金属镁、铝熔点大小关系是Mg_________Al。(填“大于”、“等于”或“小于”)
(2)氯化铝加热时易升华,实验测得铝元素与氯元素形成化合物的实际组成为Al2Cl6,其结构简式如图所示。其中处于中间的Al原子杂化轨道类型为_________杂化,分子中所有原子_________(能、不能)在同一平面上。
![]()
(3)硝酸铁和尿素在乙醇中生成[Fe(H2NCONH2)6](NO3)3三硝酸六尿素合铁![]() 。产物是一种重要的配合物,用作有机铁肥,简称铁氮肥。基态Fe3+的核外电子排布式为____________。尿素分子中
。产物是一种重要的配合物,用作有机铁肥,简称铁氮肥。基态Fe3+的核外电子排布式为____________。尿素分子中![]() 键与
键与![]() 键的数目之比为_______。NO3-的空间构型为_________,经测定N2O5晶体中存在NO2+和NO3-,NO2+中氮原子为_________杂化。
键的数目之比为_______。NO3-的空间构型为_________,经测定N2O5晶体中存在NO2+和NO3-,NO2+中氮原子为_________杂化。
(4)碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示。晶体中与相邻铁原子距离相等且最近的铁原子有________个,该物质的化学式为_________。若晶体密度为dg/cm3,则晶胞中最近的两个碳原子的距离为___________pm(阿伏加德罗常数的值为NA表示,写出简化后的计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的叙述,正确的是( )
A. 与
与 互为同分异构体
互为同分异构体
B.O2和O3互为同位素
C.苯乙烯(![]() )所有原子一定在同一平面上
)所有原子一定在同一平面上
D.H2O和D2O化学性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、SO42—)中回收氧化铁流程如图所示:

已知:常温下Ksp[Mg(OH)2]=1.2×10-11;Ksp[Fe(OH)2]=2.2×10-16;Ksp[Fe(OH)3]=3.5×10-38;Ksp[Al(OH)3]=1.0×10-33
(1)写出在该酸性废液中通入空气时发生反应的离子方程式:_____,指出使用空气的优点是:_______。
(2)已知Fe3+(aq)+3OH-(aq)===Fe(OH)3(s) ΔH=-Q1 kJ/mol,题(1)中每生成1 mol含铁微粒时,放热Q2,请你计算1 mol Fe2+全部转化为Fe(OH)3(s)的热效应ΔH=______。
(3)常温下,根据已知条件计算在pH=5的溶液中,理论上下列微粒在该溶液中可存在的最大浓度c(Fe3+)=_________。
(4)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时可能混有的杂质是_____(填化学式,下同),用____试剂可将其除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 据Ksp(AgCl)=1.77×10﹣10,Ksp(Ag2CrO4)=2.0×10﹣12,可推知AgCl溶解度比Ag2CrO4的溶解度大
B. 处理水垢时常常先用碳酸钠溶液浸泡,再用酸溶解
C. 向碳酸钡沉淀中加入稀硫酸,沉淀发生转化,可推知硫酸钡的Ksp比碳酸钡的大
D. AgCl在10 mL 0.1 mol/L的KCl溶液中溶解的质量比在10 mL0.05mol/L的AgNO3溶液中多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ksp[Mg(OH)2]=1.8×10-11 mol3·L-3,Ksp[Cu(OH)2]=2.2×10-20 mol3·L-3。向浓度为0.01 mol·L-1的Cu2+和Mg2+的混合溶液中逐滴加入NaOH溶液至过量,下列说法正确的是( )
A.较先出现的沉淀是Mg(OH)2
B.两种离子开始沉淀时,Cu2+所需溶液的pH较大
C.当两种沉淀共存时,说明溶液中完全不存在Cu2+、Mg2+
D.当两种沉淀共存时,溶液中![]() ≈8.2×108
≈8.2×108
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有些特殊的钢中含有Fe、C、Mn、V等元素,其中Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据如下表:
元素 | Mn | Fe | |
电离能(kJ/mol) | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
回答下列问题:
(1)Mn元素基态原子的价电子排布图为________。比较锰和铁两元素的电离能I2和I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是:________________。
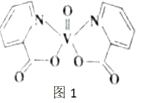
(2)钒元素的某种配合物可增强胰岛素降糖作用,它是电中性分子,结构如图1。分子中采取sp2杂化的原子有_________,1mol分子中含有配位键的数目是_____。
(3)铁元素广泛应用,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成黄血盐,其配离子结构如图![]() 离子所带电荷未标出
离子所带电荷未标出![]() 。
。
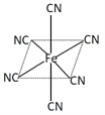
①已知CN-与N2结构相似,CN-的电子式是___________。
②化合物Fe(CO)5熔点为253K,沸点为376K,其固体属于____晶体。
③写出沉淀溶解的化学方程式_______________________________。
④图2的甲是Fe的一种晶胞,晶胞中Fe的堆积方式为___________,己知该晶体的密度为ρg/cm3用NA表示阿伏加德罗常数的值,则该晶胞的边长为___________cm。
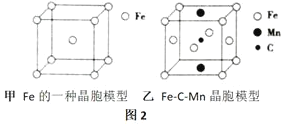
⑤图2的乙是Fe-C-Mn合金(晶体有缺陷)的一种晶胞,则与C原子等距紧邻Fe的个数为____________,该合金的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下3个热化学方程式:
H2(g)+![]() O2(g)=H2O(g) ΔH1= -a kJ·mol-1①
O2(g)=H2O(g) ΔH1= -a kJ·mol-1①
H2(g)+![]() O2(g)=H2O(l) ΔH2= -b kJ·mol-1②
O2(g)=H2O(l) ΔH2= -b kJ·mol-1②
2H2(g)+O2(g)=2H2O(l) ΔH3= -c kJ·mol-1③
则由下表所列的原因能推导出后面结论的是( )
选项 | 原因 | 结论 |
A | H2的燃烧是放热反应 | a、b、c均大于零 |
B | ①和②中物质的化学计量数均相同 | a=b |
C | ①和③中H2O的状态不同,化学计量数不同 | a、c不会有任何关系 |
D | ③的化学计量数是②的2倍 | ΔH2<ΔH3 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com