
����Ŀ����������3���Ȼ�ѧ����ʽ��
H2(g)+![]() O2(g)=H2O(g)����H1= -a kJ��mol-1��
O2(g)=H2O(g)����H1= -a kJ��mol-1��
H2(g)+![]() O2(g)=H2O(l)����H2= -b kJ��mol-1��
O2(g)=H2O(l)����H2= -b kJ��mol-1��
2H2(g)+O2(g)=2H2O(l)����H3= -c kJ��mol-1��
�����±����е�ԭ�����Ƶ���������۵���(����)
ѡ�� | ԭ�� | ���� |
A | H2��ȼ���Ƿ��ȷ�Ӧ | a��b��c�������� |
B | �ٺ͢������ʵĻ�ѧ����������ͬ | a=b |
C | �ٺ͢���H2O��״̬��ͬ����ѧ��������ͬ | a��c�������κι�ϵ |
D | �۵Ļ�ѧ�������Ǣڵ�2�� | ��H2����H3 |
A.AB.BC.CD.D
���𰸡�A
��������
A. ����ȼ�յĹ����Ƿ��ȹ��̣������ʱ�С��0����a��b��c�������㣬��A��ȷ��
B. �ʱ�Ĵ�С�뷴Ӧ����������״̬�йأ�����ʽ�١���������ˮ��״̬��һ�£���a������b����B����
C. �۵�ϵ���Ǣڵ�2�������Ԣ۵��ʱ�Ϊ�ڵ�2��������Ϊ��̬ˮת��ΪҺ̬ˮ�Ĺ���Ϊ���ȹ��̣����Ԣڵ��ʱ�С�ڢٵ��ʱ䣬������a��b��c��Ϊ���������2b=c>2a����C����
D. �۵�ϵ���Ǣڵ�2�������Ԣ۵��ʱ�Ϊ�ڵ�2������c=2b����Ϊ����ȼ���Ƿ��ȹ��̣�������H��0������H2>��H3����D����
��ȷ����A��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ksp(AgCl)��1.56��10��10��Ksp(AgBr)��7.7��10��13��Ksp(Ag2CrO4)��9.0��10��12��ij��Һ�к���Cl����Br����CrO42����Ũ�Ⱦ�Ϊ0.010 mol��L��1�������Һ����μ���0.010 mol��L��1��AgNO3��Һʱ�����������Ӳ����������Ⱥ�˳��Ϊ(����)
A.Cl����Br����CrO42��B.CrO42����Br����Cl��C.Br����Cl����CrO42�� D.Br����CrO42����Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�pH=11��NaOH��Һ��CH3COONa��Һ��5 mL���ֱ�ϡ����500mL����Һ��pH����Һ�����V���Ĺ�ϵ��ͼ��ʾ������˵����ȷ����

A. a>9
B. ϡ�ͺ����Һ���������
C. ����y��ʾNaOH��Һ�ı仯
D. N��P��M���Ӧ����Һ��ˮ�ĵ���̶���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��Ȼ�ѧ����ʽ��������ȷ���ǣ�������
A.��֪�����ȼ����Ϊ![]() ,�����ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ
,�����ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ![]()
![]()
B.��֪![]() ʯī,
ʯī,![]() ���ʯ,
���ʯ,![]() ,����ʯ��ʯī�ȶ�
,����ʯ��ʯī�ȶ�
C.��֪�к���Ϊ![]()
![]() ,��1molϡ���������ϡNaOH��Һ��Ӧ�ķ�Ӧ�Ⱦ����к���
,��1molϡ���������ϡNaOH��Һ��Ӧ�ķ�Ӧ�Ⱦ����к���
D.��֪![]() ��
��![]() ,��
,��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������̼���ɼ���Ĺ�����ͼ��ʾ������˵������ȷ����(NAΪ�����ӵ�������ֵ)
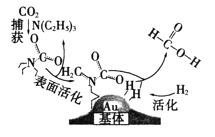
A.10.1gN(C2H5)3�������Ĺ��ۼ���ĿΪ2.1NA
B.��״���£�22.4LCO2�������ĵ�����ĿΪ16NA
C.�ڲ�������У�������̼�����еĹ��ۼ���ȫ����
D.100g 46���ļ���ˮ��Һ����������ԭ����ĿΪ5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ե��з�̪��Һ��������Һ����������ɫ�������
A. ������Һ���� B. CH3COONa��Һ����
C. ��ˮ�м�������NH4Cl���� D. С�մ���Һ�м�������NaCl����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£�Na2S��Һ�д���ˮ��ƽ�⣺S2+H2O![]() HS+OH������˵����ȷ����
HS+OH������˵����ȷ����
A.ϡ����Һ��ˮ��ƽ�ⳣ������
B.�����¶ȣ�c(HS)/c(S2)��С
C.����CuSO4���壬HSŨ�ȼ�С
D.����NaOH���壬��ҺpH��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᡢ�����̼�������������г��������ʡ����б�����ȷ���ǣ� ��
A. ��NaHCO3��Һ�м�����������ʵ�����NaOH����Һ�е�������ֻ��CO![]() ��OH-
��OH-
B. NaHCO3��Һ�У�c (H+)+ c (H2CO3)=c(OH-)
C. 10 mL0.10 mol��L-1CH3COOH��Һ��������ʵ�����NaOH����Һ�����ӵ�Ũ���ɴ�С��˳���ǣ�c(Na+)��c(CH3COO-)��c��OH-����c(H+)
D. �к������pH����ͬ��HCl��Һ��CH3COOH��Һ�����ĵ�NaOH���ʵ�����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������и�ͼ���߱�������Ϣ���ó��Ľ��۲���ȷ����( )
A.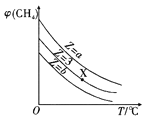 ��ʾһ�������£�CH4��H2O(g)������Ӧ��CH4(g)��H2O(g)
��ʾһ�������£�CH4��H2O(g)������Ӧ��CH4(g)��H2O(g)![]() CO(g)��3H2(g)ƽ��ʱ��(CH4)�����������Z(Z=
CO(g)��3H2(g)ƽ��ʱ��(CH4)�����������Z(Z=![]() )��T(�¶�)�Ĺ�ϵ����÷�Ӧ���ʱ���H��0����b��3��a
)��T(�¶�)�Ĺ�ϵ����÷�Ӧ���ʱ���H��0����b��3��a
B.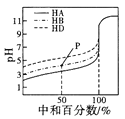 ��ʾ�����£�����ͬŨ�ȵ�NaOH��Һ���ֱ�ζ�Ũ�Ⱦ�Ϊ0.1mol/L��������(HA��HB��HD)��Һ���ζ������ߣ����Կ���������ĵ��볣����ϵΪKHA��KHB��KHD���ҵζ���P��ʱ����Һ�У�c(HB)>c(Na+)>c(B- )>c(H+)>c(OH-)
��ʾ�����£�����ͬŨ�ȵ�NaOH��Һ���ֱ�ζ�Ũ�Ⱦ�Ϊ0.1mol/L��������(HA��HB��HD)��Һ���ζ������ߣ����Կ���������ĵ��볣����ϵΪKHA��KHB��KHD���ҵζ���P��ʱ����Һ�У�c(HB)>c(Na+)>c(B- )>c(H+)>c(OH-)
C.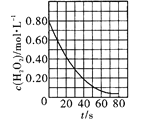 ��������H2O2���ֽ�ų������ķ�Ӧ��c(H2O2)�淴Ӧʱ��仯�����ߣ�˵�����ŷ�Ӧ�Ľ���H2O2�ֽ�������С
��������H2O2���ֽ�ų������ķ�Ӧ��c(H2O2)�淴Ӧʱ��仯�����ߣ�˵�����ŷ�Ӧ�Ľ���H2O2�ֽ�������С
D.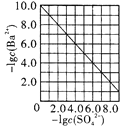 ����������Na2SO4��ȥ��Һ��Ba2+�ﵽ�����ܽ�ƽ��ʱ����Һ��c(Ba2+)��c(SO42-)�Ĺ�ϵ���ߣ�˵����Һ��c(SO42-)Խ��c(Ba2+)ԽС
����������Na2SO4��ȥ��Һ��Ba2+�ﵽ�����ܽ�ƽ��ʱ����Һ��c(Ba2+)��c(SO42-)�Ĺ�ϵ���ߣ�˵����Һ��c(SO42-)Խ��c(Ba2+)ԽС
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com