
【题目】下列有关热化学方程式的叙述正确的是( )
A.已知甲烷的燃烧热为![]() ,则甲烷燃烧的热化学方程式可表示为
,则甲烷燃烧的热化学方程式可表示为![]()
![]()
B.已知![]() 石墨,
石墨,![]() 金刚石,
金刚石,![]() ,则金刚石比石墨稳定
,则金刚石比石墨稳定
C.已知中和热为![]()
![]() ,则1mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热
,则1mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热
D.已知![]() ;
;![]() ,则
,则![]()
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】有关物质的叙述,正确的是( )
A. 与
与 互为同分异构体
互为同分异构体
B.O2和O3互为同位素
C.苯乙烯(![]() )所有原子一定在同一平面上
)所有原子一定在同一平面上
D.H2O和D2O化学性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有些特殊的钢中含有Fe、C、Mn、V等元素,其中Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据如下表:
元素 | Mn | Fe | |
电离能(kJ/mol) | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
回答下列问题:
(1)Mn元素基态原子的价电子排布图为________。比较锰和铁两元素的电离能I2和I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是:________________。
(2)钒元素的某种配合物可增强胰岛素降糖作用,它是电中性分子,结构如图1。分子中采取sp2杂化的原子有_________,1mol分子中含有配位键的数目是_____。
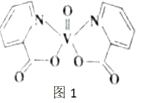
(3)铁元素广泛应用,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成黄血盐,其配离子结构如图![]() 离子所带电荷未标出
离子所带电荷未标出![]() 。
。
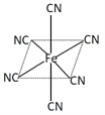
①已知CN-与N2结构相似,CN-的电子式是___________。
②化合物Fe(CO)5熔点为253K,沸点为376K,其固体属于____晶体。
③写出沉淀溶解的化学方程式_______________________________。
④图2的甲是Fe的一种晶胞,晶胞中Fe的堆积方式为___________,己知该晶体的密度为ρg/cm3用NA表示阿伏加德罗常数的值,则该晶胞的边长为___________cm。
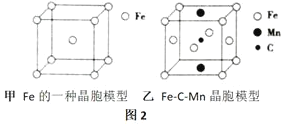
⑤图2的乙是Fe-C-Mn合金(晶体有缺陷)的一种晶胞,则与C原子等距紧邻Fe的个数为____________,该合金的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。试回答下列问题:
(1)Ni2+电子排布中,电子填充的能量最高的能级符号为______。
(2)金属Ni能与CO形成配合物Ni(CO)4.与CO互为等电子体的一种分子为______(写化学式,下同),与CO互为等电子体的一种离子为______。
(3)丁二酮肟(![]() )是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
)是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
(4)丁二酮肟常与NI2+形成图A所示的配合物,图B是硫代氧的结果:
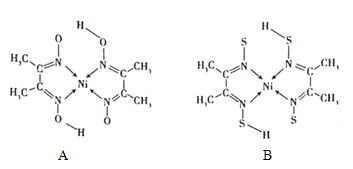
①A的熔、沸点高于B的原因为______。
②B晶体含有化学键的类型为______(填选项字母)。
A.σ键B.金属键C.配位键D.π键
(5)人工合成的氧化镍往往存在缺陷,某缺陷氧化银的组成为Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为______。
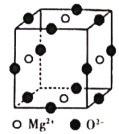
(6)Ni2+与Mg2+、O2-形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述不正确的是( )


A.用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是CuSO4溶液
B.图②装置盐桥中KCl的Cl-移向右烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应A(g)+B(g)![]() C(g)+D(g),过程中的能量变化如图所示,回答下列问题。
C(g)+D(g),过程中的能量变化如图所示,回答下列问题。

(1)该反应是________反应(填“吸热”或“放热”),该反应的ΔH=________ kJ·mol-1(用含E1,E2的代数式表示),1 mol气体A和1 mol气体B具有的总能量比1 mol气体C和1 mol气体D具有的总能量________(填“一定高”“一定低”或“高低不一定”)。
(2)若在反应体系中加入催化剂使逆反应速率增大,则E1和E2的变化是:E1________,E2________,ΔH________(填“增大”“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下3个热化学方程式:
H2(g)+![]() O2(g)=H2O(g) ΔH1= -a kJ·mol-1①
O2(g)=H2O(g) ΔH1= -a kJ·mol-1①
H2(g)+![]() O2(g)=H2O(l) ΔH2= -b kJ·mol-1②
O2(g)=H2O(l) ΔH2= -b kJ·mol-1②
2H2(g)+O2(g)=2H2O(l) ΔH3= -c kJ·mol-1③
则由下表所列的原因能推导出后面结论的是( )
选项 | 原因 | 结论 |
A | H2的燃烧是放热反应 | a、b、c均大于零 |
B | ①和②中物质的化学计量数均相同 | a=b |
C | ①和③中H2O的状态不同,化学计量数不同 | a、c不会有任何关系 |
D | ③的化学计量数是②的2倍 | ΔH2<ΔH3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如图所示。甲与戊的原子序数相差3,戊是空气中含量最多的元素,丁与辛是同周期元素。下列说法正确的是( )

A.丙不能与水发生反应
B.己和氯气反应的产物只有一种
C.丙与庚的原子核外电子数相差13
D.乙形成的氧化膜疏松,不能保护内层金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)浓度均为0.01 mol·L-1的8种溶液:①HNO3 ②H2SO4 ③CH3COOH ④Ba(OH)2 ⑤NaOH
⑥CH3COONa ⑦KCl ⑧NH4Cl,这些溶液pH由小到大的顺序是(填写编号)_________。
(2)pH=2的某酸HnA(An+为酸根)与pH=12的某碱B(OH)m混合,恰好反应生成正盐,混合液pH=8。
①反应生成的正盐的化学式为________。
②该盐中____离子一定能水解,其第一步水解的离子方程式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com