
【题目】(1)浓度均为0.01 mol·L-1的8种溶液:①HNO3 ②H2SO4 ③CH3COOH ④Ba(OH)2 ⑤NaOH
⑥CH3COONa ⑦KCl ⑧NH4Cl,这些溶液pH由小到大的顺序是(填写编号)_________。
(2)pH=2的某酸HnA(An+为酸根)与pH=12的某碱B(OH)m混合,恰好反应生成正盐,混合液pH=8。
①反应生成的正盐的化学式为________。
②该盐中____离子一定能水解,其第一步水解的离子方程式为____________。
【答案】②①③⑧⑦⑥⑤④ BnAm An- An-+H2O![]() HA(n-1)-+OH
HA(n-1)-+OH
【解析】
(1)先将物质的按照碱、盐、酸的顺序分类,再根据盐的水解和弱电解质的电离特点比较PH,再按照溶液的PH由大到小进行排序;
(2)pH=2的某酸HnA(A为酸根)与pH=12的某碱B(OH)m等体积混合生成正盐,说明酸中氢离子的总物质的量和碱中氢氧根离子的总物质的量相等,其盐溶液呈碱性,说明碱的电离程度大于酸的电离程度,根据化合物中化合价的代数和为0确定其化学式,根据酸碱的相对强弱确定水解的离子。
(1)属于碱的为:④Ba(OH)2⑤NaOH,浓度相同时,碱性④>⑤;
水解呈碱性的为:⑥CH3COONa,但水解程度较小,则pH:④>⑤>⑥;
溶液呈中性的为:⑦KCl;
溶液呈酸性的有:①②③⑧,其中①为一元强酸,②为二元强酸,③为弱酸,⑧水解呈酸性,浓度相同时,
溶液的pH:②<①<③<⑧,
综合以上分析可知,溶液的pH由大到小的顺序是为:④⑤⑥⑦⑧③①②,
故答案为:④⑤⑥⑦⑧③①②;
(2)①HnA中A的化合价是n价,B(OH)m中B的化合价是+m价,根据化合物中化合价的代数和为0知,二者的离子个数之比为n:m,则其化学式为:BnAm,
故答案为:BnAm;
②根据题意知,其正盐溶液呈碱性,说明碱的电离程度大于酸的电离程度,生成的盐是强碱弱酸盐,则An离子一定能水解,其水解方程式为:An+H2OHA(n1)+OH,
故答案为:An; An+H2OHA(n1)+OH。


科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A.已知甲烷的燃烧热为![]() ,则甲烷燃烧的热化学方程式可表示为
,则甲烷燃烧的热化学方程式可表示为![]()
![]()
B.已知![]() 石墨,
石墨,![]() 金刚石,
金刚石,![]() ,则金刚石比石墨稳定
,则金刚石比石墨稳定
C.已知中和热为![]()
![]() ,则1mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热
,则1mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热
D.已知![]() ;
;![]() ,则
,则![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是( )
A. 在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO![]() 和OH-
和OH-
B. NaHCO3溶液中:c (H+)+ c (H2CO3)=c(OH-)
C. 10 mL0.10 mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D. 中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其中pH与溶液体积V的关系如图所示,下列说法正确的是

A. 稀释前,A、B两酸溶液的物质的量浓度一定相等
B. 稀释后,A酸溶液的酸性比B酸溶液强
C. a=5时,A是强酸,B是弱酸
D. 稀释导致B酸的电离程度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置图及实验用品均正确的是![]() 部分夹持仪器未画出)( )
部分夹持仪器未画出)( )
A.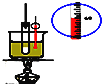 实验室制硝基苯
实验室制硝基苯
B.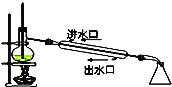 石油分馏
石油分馏
C.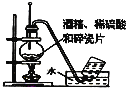 实验使用经酒精制取乙烯
实验使用经酒精制取乙烯
D.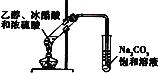 实验室制乙酸乙酯
实验室制乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量的浓度和混合液的pH如下表所示:
实验编号 | HA的物质的量浓度(mol·L-1) | NaOH的物质的量浓度(mol·L-1) | 混合后溶液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还弱酸? 。
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)= mol/L。
Ⅱ.某二元酸(分子式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB-![]() H++B2-
H++B2-
回答下列问题:
(5)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 。
A.c(B2-)+c(HB-)=0.1mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列各图曲线表征的信息,得出的结论不正确的是( )
A.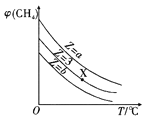 表示一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)
表示一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)平衡时φ(CH4)的体积分数与Z(Z=
CO(g)+3H2(g)平衡时φ(CH4)的体积分数与Z(Z=![]() )和T(温度)的关系,则该反应的焓变△H>0,且b>3>a
)和T(温度)的关系,则该反应的焓变△H>0,且b>3>a
B.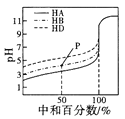 表示室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol/L的三种酸(HA、HB和HD)溶液,滴定的曲线,可以看出三种酸的电离常数关系为KHA>KHB>KHD,且滴定至P点时,溶液中:c(HB)>c(Na+)>c(B- )>c(H+)>c(OH-)
表示室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol/L的三种酸(HA、HB和HD)溶液,滴定的曲线,可以看出三种酸的电离常数关系为KHA>KHB>KHD,且滴定至P点时,溶液中:c(HB)>c(Na+)>c(B- )>c(H+)>c(OH-)
C.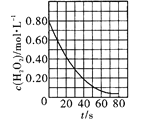 是室温下H2O2催化分解放出氧气的反应中c(H2O2)随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
是室温下H2O2催化分解放出氧气的反应中c(H2O2)随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
D.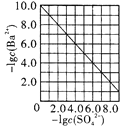 是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+)与c(SO42-)的关系曲线,说明溶液中c(SO42-)越大c(Ba2+)越小
是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+)与c(SO42-)的关系曲线,说明溶液中c(SO42-)越大c(Ba2+)越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应a A(g)+b B(g)![]() c C(g) ΔH<0在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
c C(g) ΔH<0在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
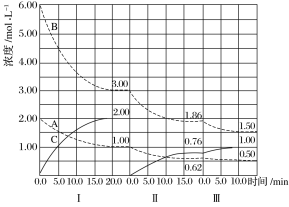
(1)反应的化学方程式中a∶b∶c为_____________________________________________。
(2)A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为______________。
(3)B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是________,其值是________。
(4)由第一次平衡到第二次平衡,平衡向________移动,采取的措施是________________________。
(5)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2________(填“<”“>”或“=”)T3,判断的理由是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,其反应如下: 2CH4(g) ![]() C2H4(g) +2H2(g) ΔH>0
C2H4(g) +2H2(g) ΔH>0
化学键 | H—H | C—H | C = C | C—C |
E(kJ / mol) | a | b | c | d |
(1)已知相关化学键的键能如上表,甲烷制备乙烯反应的ΔH=___________ (用含a.b.c.d的代数式表示)。
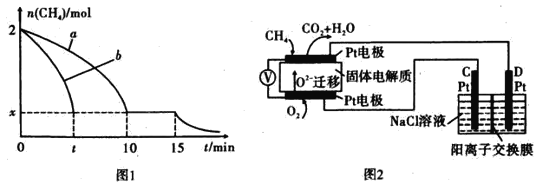
(2)T1温度时,向1 L的恒容反应器中充入2 molCH4 ,仅发生上述反应,反应过程中 0~15 min CH4的物质的量随时间变化如图1所示,测得10-15 min时H2的浓度为1.6 mol/L。
①0~ 10 min内CH4表示的反应速率为____mol/(Lmin) o
②若图中曲线a、曲线b分别表示在温度T1时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n (CH4)变化曲线,其中表示催化剂表面积较大的曲线是 ________ (填"a"或 “b”)。
③15 min时,若改变外界反应条件,导致n( CH4)发生图中所示变化,则改变的条件可能是_____(任答一条即可)。
(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4).c2(H2) 其中K正、K逆为速率常数仅与温度有关,T1温度时k正与K逆的比值为______ (填数值)。若将温度由T1升高到T2,则反应速率增大的倍数V正 ____V逆(填“>”“=”或“<”),判断的理由是__________
(4)科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了 Y2O3与 ZrO2的固体,可在高温下传导O2-
①C极的Pt为_______ 极(选填“阳”或“阴” )。
②该电池工作时负极反应方程式为_____________________ 。
③用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为112 mL,则阴极区所得溶液c(OH—)=_______ (假设电解前后溶液的体积均为500 mL)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com