
【题目】镁、铝、铁是三种重要金属,它们的单质和化合物应用十分广泛。回答下列问题:
(1)镁、铝第一电离能大小的关系是I1(Mg)_________I1(Al),金属镁、铝熔点大小关系是Mg_________Al。(填“大于”、“等于”或“小于”)
(2)氯化铝加热时易升华,实验测得铝元素与氯元素形成化合物的实际组成为Al2Cl6,其结构简式如图所示。其中处于中间的Al原子杂化轨道类型为_________杂化,分子中所有原子_________(能、不能)在同一平面上。
![]()
(3)硝酸铁和尿素在乙醇中生成[Fe(H2NCONH2)6](NO3)3三硝酸六尿素合铁![]() 。产物是一种重要的配合物,用作有机铁肥,简称铁氮肥。基态Fe3+的核外电子排布式为____________。尿素分子中
。产物是一种重要的配合物,用作有机铁肥,简称铁氮肥。基态Fe3+的核外电子排布式为____________。尿素分子中![]() 键与
键与![]() 键的数目之比为_______。NO3-的空间构型为_________,经测定N2O5晶体中存在NO2+和NO3-,NO2+中氮原子为_________杂化。
键的数目之比为_______。NO3-的空间构型为_________,经测定N2O5晶体中存在NO2+和NO3-,NO2+中氮原子为_________杂化。
(4)碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示。晶体中与相邻铁原子距离相等且最近的铁原子有________个,该物质的化学式为_________。若晶体密度为dg/cm3,则晶胞中最近的两个碳原子的距离为___________pm(阿伏加德罗常数的值为NA表示,写出简化后的计算式即可)。

【答案】大于 小于 sp3 不能 3d5 7:1 平面三角形 sp 12 FeC ![]() ×
×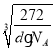 ×1010
×1010
【解析】
(1)同一周期元素,其第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;原子轨道中电子处于半满、全满、全空时最稳定;根据金属元素的原子半径及金属键强弱分析判断物质熔沸点高低;
(2)根据球棍模型分析判断;
(3)原子形成阳离子时,先失去高能层中的电子,同一能层先失去高能级上的电子;尿素中C原子形成3个σ键、没有孤电子对,N原子形成3个σ键、由1对孤电子对,杂化轨道数目分别为3、4;单键为σ键,双键中含有1个σ键、1个π键;根据NO3-中N原子的价层电子对对确定其空间构型;结合等电子体结构相似,性质相似分析判断原子杂化类型;
(4)Fe原子处于顶点、面心,碳原子处于体心、棱中心。用均摊方法计算。
(1)同一周期元素,其第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,Mg、Al位于同一周期且Mg位于第IIA族、Al位于第IIIA族,所以第一电离能:I1(Mg)>I1(Al);由于原子半径Mg>Al,所以金属键Al>Mg,金属键越强,断裂金属键使物质熔化、气化需要消耗的能量就越高,物质的熔沸点就越高,所以熔点:Mg<Al;
(2)在Al2Cl6中,Al形成了4个共价键,3个为![]() 键,1个为配位键,所以Al原子杂化方式为sp3杂化;1个Al原子和4个Cl形成正四面体结构,因此分子中所有原子不能在同一平面上;
键,1个为配位键,所以Al原子杂化方式为sp3杂化;1个Al原子和4个Cl形成正四面体结构,因此分子中所有原子不能在同一平面上;
(3)Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子和3d上1个电子形成Fe3+,所以基态Fe3+的核外价电子排布式为3d5;在尿素分子H2NCONH2中,中心原子为C原子,形成3个σ键、1个π键;2个亚氨基中每个亚氨基中![]() 键的数目2,则一分子尿素中含
键的数目2,则一分子尿素中含![]() 键的数目为3+2×2=7,所以分子中σ键和π键个数比为7:1;NO3-中N原子孤电子对数
键的数目为3+2×2=7,所以分子中σ键和π键个数比为7:1;NO3-中N原子孤电子对数![]() =0,价层电子对数3+0=3,所以其空间构型为平面三角形;NO2+与CO2互为等电子体,结构相似,其中氮原子类型与CO2分子中C原子相同,都是为sp杂化;
=0,价层电子对数3+0=3,所以其空间构型为平面三角形;NO2+与CO2互为等电子体,结构相似,其中氮原子类型与CO2分子中C原子相同,都是为sp杂化;
(4)Fe原子处于顶点、面心,碳原子处于体心、棱中心。以顶点Fe原子研究,与之距离最近的Fe原子处于面心,每个顶点为8个晶胞共用,每个面为2个晶胞共用,故与铁原子距离最近的铁原子数目为![]() =12;晶胞中Fe原子数目
=12;晶胞中Fe原子数目![]() =4、C原子数目1+
=4、C原子数目1+![]() =4,n(Fe):n(C)=4:4=1:1,所以该物质化学式为:FeC;晶胞中最近的两个碳原子的距离为面对角线的一半,设晶胞中最近的两个碳原子的距离为rpm,则晶胞棱长
=4,n(Fe):n(C)=4:4=1:1,所以该物质化学式为:FeC;晶胞中最近的两个碳原子的距离为面对角线的一半,设晶胞中最近的两个碳原子的距离为rpm,则晶胞棱长![]() rpm,晶胞质量
rpm,晶胞质量,解得r=
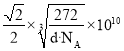 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下图所示为工业合成氨的流程图。有关说法错误的是

A. 步骤①中“净化”可以防止催化剂中毒
B. 步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率
C. 步骤③、④、⑤均有利于提高原料的转化率
D. 产品液氨除可生产化肥外,还可用作制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.92g甲苯(分子式为C7H8,常温下为液态)在足量的O2中燃烧,生成CO2气体和液态水,放出39.43kJ的热量。该反应的热化学方程式为__________。
(2)将煤转化为水煤气(CO和H2的混合气体)是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为:C(s) + H2O(g)=CO(g) + H2(g);△H1。
已知:①2H2(g) + O2(g) = 2H2O(g);△H2=-483.6kJ·mol-1,
②2C(s) + O2(g) = 2 CO(g); △H3=-221.0kJ·mol-1,
结合上述热化学方程式,计算得出△H1= _______。
(3)反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。

①该反应是___________反应(填“吸热”、“放热”)。
②在反应体系中加入催化剂,化学反应速率增大, E1、E2和ΔH的变化是:E1________,E2_______,ΔH _______(填“增大”、“减小”或“不变”)
③当反应达到平衡时,其他条件不变,升高温度,A的转化率______(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3-CH=CH2+HBr![]() CH3-CHBr-CH3主要产物
CH3-CHBr-CH3主要产物![]() 。1mol烃A充分燃烧后可以得到
。1mol烃A充分燃烧后可以得到![]() 和
和![]() 。烃A在不同条件下能发生如下图所示的一系列变化。
。烃A在不同条件下能发生如下图所示的一系列变化。
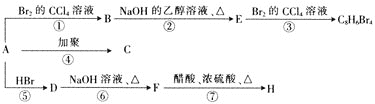
(1)A的结构简式为______。
(2)上述反应中,①是________反应,⑦是________反应。![]() 填反应类型
填反应类型![]()
(3)写出C、H的结构简式:C______________H____________
(4)写出反应D→F的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOH ![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:

| 苯 | 溴 | 溴苯 |
密度 | | | |
沸点 | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入![]() 液态溴。向a中滴入几滴溴,有白雾产生,是因为生成了________气体。继续滴加至液溴滴完。装置d的作用是________________________;
液态溴。向a中滴入几滴溴,有白雾产生,是因为生成了________气体。继续滴加至液溴滴完。装置d的作用是________________________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、![]() 的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是_____;
的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是_____;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是______;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中必需的是___![]() 填入正确选项前的字母
填入正确选项前的字母![]() ;
;
a.重结晶 b.过滤 c.蒸馏 d.萃取
(4)在该实验中,a的容积最适合的是________。
a.25 mL ![]()
![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0molPCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是( )
A. 0.4mol
B. 0.2mol
C. 小于0.2mol
D. 大于0.2mol,小于0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO42—,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A.Cl-、Br-、CrO42—B.CrO42—、Br-、Cl-C.Br-、Cl-、CrO42— D.Br-、CrO42—、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH=11的NaOH溶液和CH3COONa溶液各5 mL,分别稀释至500mL,溶液的pH与溶液体积(V)的关系如图所示,下列说法正确的是

A. a>9
B. 稀释后的溶液耗酸量相等
C. 曲线y表示NaOH溶液的变化
D. N、P、M点对应的溶液中水的电离程度依次增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com